Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Просмотров: 774
17.01.2012
АРГОН АРГОН (от греч. argos - недеятельный; лат Argon) Ar, хим. элемент
VIII гр. периодич. системы, относится к благородным газам, ат. н. 18, ат.
м. 39,948. Прир. аргон состоит из изотопов с мас. ч. 36 (0,337% по объему),
38 (0,063%), 40 (99,600%), т.е., в отличие от др. легких элементов, преобладает
самый тяжелый изотоп. Причина этого - концентрирование 40Аг
в атмосфере в результате распада в литосфере 40К посредством
захвата орбитального электрона: К + + е -> 40Аг+ Аргон - самый распространенный из благородных газов элемент. В атмосфере его содержится 0,934% по объему (4*1014т), в литосфере - 4*10-6% по массе. Аргон - одноатомный газ без цвета и запаха; т. кип. 87,29 К; плотн. 0,001784
г/см3 (жидкого при 87 К - 1,40 г/см3, твердого при
40 К -1,40 г/см3); ркрит 0,4894 МПа; dкрит
0,536 г/см3; тройная точка: т-ра 83,81 К, давл. 68,9 кПа, плотн.
1,623 г/см3; Сp° 20,79 Дж/(моль*К);
Просмотров: 509
17.01.2012
ХЛОР ХЛОР (от греч. chloros - желто-зеленый;
лат. Chlorum) C1, хим. элемент VII гр. периодич. системы, относится к галогенам;
ат. н. 17, ат. м. 35,453. Прир. хлор состоит из смеси двух изотопов 35С1
(75,77%) и 37С1 (24,23%); ядра обоих изотопов имеют электрич.
квадрупольный момент. Конфигурация внеш. электронной оболочки атома 3s23р5;
степени окисления -1 (хлориды), +1 (гипохлориты), +3 (хлориты),
+5
(хлораты)и +7 (перхлораты); сродство к электрону 3,614 эВ;
потенциал ионизации при последоват. переходе от С1° к С17+ 12,96776,
23,805, 39,90, 53,50, 67,80, 96,7 и 114,27 эВ; электроотрицательность по
Полингу 3,16; ковалентный радиус С1° 0,099 нм; ионные радиусы (в скобках
указаны координац. числа) Сl-0,167 нм (6), С15+ 0,026
нм (3), С17+ 0,022 нм (4), 0,041 нм (6).
Просмотров: 610
17.01.2012
СЕРА СЕРА (Sulfur) S,
хим. элемент VI гр. периодич. системы, ат. н. 16, ат. м. 32,066; относится к
халькогенам. Природная сера состоит из четырех изотопов: 32S
(95,084%), 33S(0,74%), 34S(4,16%), 36S(0,016%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 0,52·10-28
м2. Конфигурация внеш. электронной оболочки атома 3s2
3р4; наиб. характерные степени окисления — 2, +4, +6; энергии ионизации
при последоват. переходе от S0 к S6+ равны соотв. 10,3601,
23,35, 34,8, 47,29, 72,5, 88,0 эВ; сродство к электрону 2,0772 эВ; электроотрицательность
по Полингу 2,58; атомный радиус 0,104 нм. ионные радиусы (в скобках даны координац.
числа), нм: S2- 0,170 (6), S4+ 0,051 (6), S6+ 0,026
(4). Сера-довольно распространенный
элемент, среднее содержание в земной коре 0,05 % по массе, в воде морей и океанов
0,09%. Известны многочисл. минералы серы: самородная сера (главные месторождения
в США, СНГ, Мексике, Италии, Японии); сульфидные минералы-пирит FeS2,
антимонит Sb2S3, галенит PbS, киноварь HgS, сфалерит и
вюрцит ZnS, ковеллин CuS, халькозин Cu2S, аргентит Ag2S,
висмутин Bi2S3, халькопирит CuFeS2 и др.; сульфаты
-барит BaSO4, ангидрит CaSO4, гипс CaSO4·2H2O,
мирабилит Na2SO4 x x 10Н2 О и др.
Кроме того, сера присутствует в виде соед. в углях, сланцах, нефти, прир. газах.
Сера-биогенный элемент, входит в состав белков, витаминов. Свойства. До 95,39°С
стабильна a-S-при комнатной т-ре лимонно-желтые кристаллы (табл. 1); выше
95,39° С стабильна b-S-при комнатной т-ре бледно-желтые кристаллы,
DН перехода a
Просмотров: 809
17.01.2012
ФОСФОР ФОСФОР (от греч. phosphoros - светоносный; лат. Phosphorus) P, хим. элемент V гр. периодич. системы; ат. номер 15, ат. м. 30,97376. Имеет один устойчивый нуклид 31P. Эффективное сечение захвата тепловых нейтронов 18 · 10-30 м2. Конфигурация внеш. электронной оболочки атома 3s23p3; степени окисления -3, +3 и +5; энергия последоват. ионизации при переходе от Р° до P5+ (эВ): 10,486, 19,76, 30,163, 51,36, 65,02; сродство к электрону 0,6 эВ; электроотрицательность по По-лингу 2,10; атомный радиус 0,134 нм, ионные радиусы (в скобках указаны координац. числа) 0,186 нм для P3- , 0,044 нм (6) для P3+, 0,017 нм (4), 0,029 нм (5), 0,038 нм (6) для P5+. Среднее содержание фосфора в
земной коре 0,105% по массе, в воде морей и океанов 0,07 мг/л. Известно ок.
200 фосфорных минералов,
все они представляют собой фосфаты. Из них важнейший - апатит, к-рый
является основой фосфоритов. Практич. значение имеют также монацит CePO4,
ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe,
Mn)PO4, торбернит Cu(UO2)2(PO4)2·
12H2O, отунит Ca(UO2)2(PO4)2
x x 10H2O, вивианит Fe3(PO4)2· 8H2O,
пироморфит Рb5(РО4)3С1, бирюза СuА16(РО4)4(ОН)8·
5Н2О.
Просмотров: 620
17.01.2012
НЕОН НЕОН (от греч. neos-новый;
лат. Neon) Ne, хим. элемент VIII гр. периодич. системы; относится к благородным
газам; ат. н. 10, ат.м. 20,179. Природный неон состоит из изотопов 20Ne
(90,92% по объему), 21Ne (0,257%), 22Ne (8,82%). Поперечное
сечение захвата тепловых нейтронов для прир. смеси изотопов не более 2,8.10-28
м2. Известны коротко-живущие (T1/2 < 200 с) изотопы
неона. Конфигурация внеш. электронной оболочки атома 2s22p6;
энергия ионизации Ne0 Содержание неона в атмосфере 1,82.10-3% по объему, в земной коре 7•10-5 г/т; запасы неона оцениваются в 7,8.1014 м3. Неон представлен в горячих звездах-красных гигантах, газовых туманностях, атмосфере Юпитера, Сатурна, Урана. Нептуна, Плутона. Считают, что в космосе преобладает 20Ne.
Просмотров: 769
17.01.2012
ФТОР ФТОР (отгреч. phthoros
- разрушение; лат. Fluorum) F, хим. элементVП гр. периодич. системы, относится
к галогенам; ат. н. 9, ат. м. 18,998403. Прир. фтор состоит из одного стабильного
нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1 ·10-31
м2. Конфигурация внеш. электронной оболочки атома 2s22p5
степень окисления -1; энергии ионизации при последоват. переходе от F0
к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868
кДж/моль; сродство к электрону 327,8 кДж/моль. Фтор- самый электроотрицат. элемент,
его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны
координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6).
Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия
гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением. Молекула своб. фтора двухатомна,
межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению
с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль). Содержание фтора в земной коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал, имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения к-рого встречаются на всех континентах, а наиб. запасы сосредоточены в США, Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание фтора в пром. рудах CaF2 122, в перспективных - 236 млн. т (1984, без СССР). В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане, в Забайкалье, Приморском крае и др
Просмотров: 792
17.01.2012
КИСЛОРОД КИСЛОРОД (лат Oxygenium, от греч.
oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы,
ат. н. 8, ат. м. 15,9994. Прир. кислород состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18О (0,204%]. Конфигурация внеш. электронной оболочки атома 2s22p; энергии ионизации О°:О+:О2+ равны соотв. 13,61819, 35,118 эВ; электроотрицательность по Полингу 3,5 (наиб. электроотрицат. элемент после F); сродство к электрону 1,467 эВ; ковалентный радиус 0,066 нм.
Молекула кислорода двухатомна. Существует также аллотропная модификация кислорода озон О3. Межатомное расстояние в молекуле О2 0,12074 нм; энергия ионизации О2 12,075 эВ;
сродство к электрону 0,44 эВ; энергия диссоциации 493,57 кДж/моль, константа диссоциации Кр=pO2/pO2 составляет 1,662.10-1 при 1500 К, 1,264.10-2 при 3000 К, 48,37 при 5000 К; ионный радиус О2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное 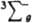 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему кислород парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему кислород парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 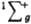 (энергия возбуждения 156,8 кДж/моль).
Кислород-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. кислорода, в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 минералов, в состав к-рых входит кислород. Убыль кислорода в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением кислорода растениями при фотосинтезе. Кислород входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%. (энергия возбуждения 156,8 кДж/моль).
Кислород-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. кислорода, в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 минералов, в состав к-рых входит кислород. Убыль кислорода в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением кислорода растениями при фотосинтезе. Кислород входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Просмотров: 932
17.01.2012
АЗОТ АЗОТ (от греч. а--приставка, здесь означающая отсутствие, и 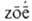 -жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6). -жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
Молекула азота двухатомна, связь между атомами тройная (длина 0,110 нм). Энергия термич. диссоциации молекулы велика (941,64 кДж/моль), поэтому диссоциация становится заметной лишь при очень высоких т-рах. Так, при 3000°С и нормальном давлении диссоциирована лишь 0,1% молекул. Общее содержание азота в земной коре 1*10-2 % по массе. Наиб. часть азота находится в своб. состоянии в атмосфере (азот - главная составная часть воздуха: 75,6% по массе или 78,09% по объему). В связанном состоянии азот встречается в воздухе, в водах рек, морей и океанов. В земной коре он образует три осн. типа минералов, содержащих ионы CN-, NO3- и NH+4. Пром. значение имеет натриевая (чилийская) селитра NaNO3, крупные залежи к-рой находятся в Чили; в сравнительно больших кол-вах встречается калиевая (индийская) селитра KNO3. В виде нейтральных и ионизир. атомов, а также в виде соед. [NO, (CN)2, NH3] азот обнаружен в составе газовых облаков комет, в туманностях и в атмосфере Солнца. Азот входит в состав всех живых организмов. В небольших кол-вах содержится в каменном угле (1,0-2,5%) и нефти (0,2-1,7%). Велико значение азота в жизнедеятельности растений и животных: в белках его до 17%, в организме человека в целом ок. 3%.
Просмотров: 616
17.01.2012
УГЛЕРОД УГЛЕРОД
(Carboneum) C, хим. элемент IV гр. периодич. системы, ат. н. 6, ат.м. 12.011.
Природный углерод состоит из двух стабильных изотопов - 12C (98,892%)
и 13C (1,108%). Сечение захвата тепловых нейтронов 3,5·10-31
м2. В атмосфере присутствует радиоактивный нуклид 14C.
Он постоянно образуется в ниж. слоях стратосферы в результате воздействия нейтронов
космич. излучения на ядра азота по р-ции: 14N (n, р)14C.
Конфигурация внеш. электронной оболочки атома углерода 2s22p2;
степени окисления +4, -
4, редко +2 (СО, карбонилы металлов), +3 (C2N2, галоген-цианы);
сродство к электрону 1,27 эВ; энергий ионизации при последоват. переходе от
С° к C4+ соотв. 11,26040, 24,383, 47,871 и 64,19 эВ; электроотрицательность
по Полингу 2,5; атомный радиус 0,077 нм, ионный радиус C4+ (в скобках
даны координац. числа) 0,029 нм (4), 0,030 нм (6). Содержание углерода в земной коре 0,48% по массе. Свободный углерод находится в природе в виде алмаза и графита. Осн. масса углерода встречается в виде карбонатов природных (известняки и доломиты), горючих ископаемых - антрацит (94-97% С), бурые угли (64-80% С), каменные угли (76-95% С), горючие сланцы (56-78% С), нефть (82-87% С), газы природные горючие (до 99% CH4), торф (53-62% С), а также битумы и др. В атмосфере и гидросфере углерод находится в виде углерода диоксида CO2, в воздухе 0,046% CO2 по массе, в водах рек, морей и океанов в ~ 60 раз больше. Углерод входит в состав растений и животных (~18%). Кругооборот углерода в природе включает биол. цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива, из вулканич. газов, горячих минер. источников, из поверхностных слоев океанич. вод и др. Биол. цикл состоит в том, что углерод в виде CO2 поглощается из тропосферы растениями, затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растит, материалов - в почву и в виде CO2 - в атмосферу.
Просмотров: 692
17.01.2012
БОР БОР (от позднелат. borax - бура; лат. Borum) В, хим. элемент III гр. периодич. системы, ат. н. 5, ат. м. 10,811. Прир. бор состоит из двух стабильных изотопов - 10В (19,57%) и 11В (80,43%). Поперечное сечение захвата тепловых нейтронов 10B 3*10-25 м2, 11В 4*10-32 м2. Конфигурация внеш. электронной оболочки 2s22р; степень окисления + 3, редко + 2; энергия ионизации при последоват. переходе от В° к В5+ соотв. 8,29811, 25,156, 37,92, 259,30 и 340,13 эВ; атомный радиус 0,097 нм, ковалентный 0,088 нм, металлический 0,091 нм, ионный В3+ 0,025 нм (координац. число 4). Содержание бора в земной коре 5*10-3% по массе, в воде океанов - 4,6 мг/л. В природе в своб. виде не встречается. Важнейшие минералы - бура Na2B4O7*10Н2О, кернит Na2B4O7*4HaO. На земной пов-сти бор мигрирует и концентрируется в рассолах озер и морей. Главные осадочные бо-ратные месторождения находятся в СССР, США, ГДР. Мировые запасы бора ок. 100 млн. т. |
ЧасыОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|



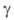 (превращ. 12% 40К). Поперечное сечение захвата тепловых
(превращ. 12% 40К). Поперечное сечение захвата тепловых  Нопл
1,17 кДж/
Нопл
1,17 кДж/ Н°исп
6,51 кДж/
Н°исп
6,51 кДж/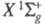 и
и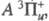 последнее
-возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния
коррелируют с валентными состояниями
последнее
-возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния
коррелируют с валентными состояниями 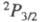 и
и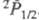 . Сродство
С12 к
. Сродство
С12 к 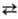
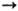 Ne+
Ne+
 Ne+2
соотв. 2080,66 и 3963,52 кДж/
Ne+2
соотв. 2080,66 и 3963,52 кДж/


 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0