Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
ФОСФОР
Просмотров: 811
17.01.2012
ФОСФОР
ФОСФОР (от греч.
phosphoros - светоносный; лат. Phosphorus) P, хим. элемент V гр. периодич. системы;
ат. номер 15, ат. м. 30,97376. Имеет один устойчивый нуклид 31P.
Эффективное сечение захвата тепловых нейтронов 18 · 10-30 м2.
Конфигурация внеш. электронной оболочки атома 3s23p3;
степени окисления -3, +3 и +5; энергия последоват. ионизации при переходе
от Р° до P5+ (эВ): 10,486, 19,76, 30,163, 51,36, 65,02; сродство
к электрону 0,6 эВ; электроотрицательность по По-лингу 2,10; атомный радиус
0,134 нм, ионные радиусы (в скобках указаны координац. числа) 0,186 нм для P3-
, 0,044 нм (6) для P3+, 0,017 нм (4), 0,029 нм (5), 0,038 нм (6)
для P5+. Среднее содержание фосфора в
земной коре 0,105% по массе, в воде морей и океанов 0,07 мг/л. Известно ок.
200 фосфорных минералов,
все они представляют собой фосфаты. Из них важнейший - апатит, к-рый
является основой фосфоритов. Практич. значение имеют также монацит CePO4,
ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe,
Mn)PO4, торбернит Cu(UO2)2(PO4)2·
12H2O, отунит Ca(UO2)2(PO4)2
x x 10H2O, вивианит Fe3(PO4)2· 8H2O,
пироморфит Рb5(РО4)3С1, бирюза СuА16(РО4)4(ОН)8·
5Н2О. Свойства. Известно
св. 10 модификаций фосфора, из них важнейшие - белый, красный и черный фосфор (техн.
белый фосфор наз. желтым фосфором). Единой системы обозначений модификаций фосфора нет. Некоторые
св-ва важнейших модификаций сопоставлены в табл. Термодинамически устойчив при
нормальных условиях кристаллич. черный фосфор (P I). Белый и красный фосфоры мета-стабильны,
но вследствие малой скорости превращения могут практически неограниченное время
сохраняться при нормальных условиях. СВОЙСТВА ВАЖНЕЙШИХ МОДИФИКАЦИЙ
ФОСФОРА
а Под
давлением. б Т-ра кипения. Белый фосфор ( Зависимость давления пара
белого фосфора от т-ры: для твердого lg p (мм рт. ст.) = 19,0925 - 35291,4/Т-
3,5 lg T (273-317 К); для жидкого lg p (мм рт. ст.) = 4,512-2660/Т+1,243
lg T (317,3-530 К). Расплав белого фосфора очень легко переохлаждается. Плотн.
расплава 1,749 г/см3. Нагревание (без доступа
воздуха) выше ~ 180 0C разрушает систему связей групп P4,
в результате чего начинается полимеризация, приводящая к превращению в красный
фосфор. Описан целый ряд разновидностей красного фосфора, различающихся по цвету - от
оранжевого и ярко-красного до коричневого и черно-фиолетового, по плотности
(2,0-2,4 г/см3), т-ре плавления (585-610 0C) и т.п. При
250-300 0C образуется аморфный
красный фосфор При давлении более 1,2
ГПa белый фосфор переходит в кристаллич. черный фосфор (P I, При давлении 8,6 ГПа образуется
фосфор V с ромбоэдрич. структурой типа Белый и красный фосфор- диэлектрики,
черный фосфор- полупроводник, модификации высокого давления, по-видимому, обладают
металлич. св-вами. Сверхпроводимость наблюдается у модификаций P V и P VI ниже
соотв. 4,7-6 К и 7,5-10 К (в зависимости от давления). Белый фосфор очень активен.
При переходе к красному и особенно черному фосфору хим. активность резко снижается.
Белый фосфор на воздухе светится в темноте, с чем исторически связано его назв.
(греч. phosphoros - светоносный). Свечение обусловлено окислением (с образованием
низших оксидов) паров фосфора - белый фосфор обладает заметной летучестью даже при низких
т-рах. Мелкодисперсный белый фосфор самовоспламеняется на воздухе, для компактного
т. воспл. 34-50 0C. В воде он почти не раств. (3 · 10-4%
при 15 0C), очень хорошо раств. в CS2 (89,8% при 10 0C),
раств. в PCl3, POCl3, жидких SO2, NH3,
мало раств. в этаноле (0,31%), диэтиловом эфире (1,04%), бензоле (3,2%), CCl4
(1,27%), глицерине (0,17%), уксусной к-те (~ 1%), ксилоле. Для красного и черного
фосфора р-рители не найдены. Красный фосфор при комнатной
т-ре окисляется медленно, но нек-рые его образцы могут самовоспламеняться из-за
присут. следов белого фосфора, а также наличия высокоактивного аморфного фосфора по границам
зерен. T. воспл. красного фосфора 210 С (черного фосфора ок. 500 0C), но большие
кол-ва красного фосфора при длит. хранении на воздухе могут загораться из-за повышения
т-ры вследствие окисления. При горении фосфора образуется
оксид P4O10 (или P2O5, см. Фосфора
оксиды). С парами воды фосфор реагирует под давлением при 600-900 0C
в присут. катализаторов (Pt, Cu и др.) с вытеснением H2 и образованием
H3PO4 (см. Фосфорная кислота). Р-ры неокисляющих
минеральных к-т на фосфор не действуют, HNO3 окисляет его до H3PO4.
При нагр. фосфора с р-рами щелочей выделяется фосфин PH3. Белый
фосфор реагирует с р-рами
солей электроположит. металлов (Cu, Pb, Ag и др.), вытесняя их из р-ров с образованием
фосфидов. Красный и черный фосфоры этой способностью не обладают. С водородом фосфор в обычных
условиях не реагирует. Его гидриды (фосфины) получают косвенным путем. С фтором
и белый и красный фосфоры реагируют со взрывом. Белый фосфор воспламеняется в атмосфере
хлора и паров брома, красный реагирует спокойно. Р-ция с иодом у белого фосфора идет
даже при охлаждении, тогда как у красного - при нагревании. Во всех случаях
образуются разл. фосфора галогениды. При нагр. фосфора в атмосфере галогеноводородов
образуются фосфин и соли фосфония. Пары фосфора реагируют с азотом в электрич. разряде или на накаленной вольфрамовой нити с образованием смеси аморфных нитридов P3N5 и PN. Обычно нитрид P3N5 (оранжево-коричневого цвета с плотн. 2,6 г/см3) получают взаимод. P4S10 с NH3 при нагревании. При его термич. разложении при ~ 800 0C м. б. получен полимерный низший нитрид PNx переменного состава (х = 0,7 до 1,19). Нитриды фосфора инертны, холодная вода на них не действует, они не разлагаются при нагр. в р-рах HCl, разб. HNO3, р-рах щелочей, не реагируют с хлором, на воздухе начинают окисляться выше 250 0C. Нитрид P3N5 используют как газопоглотитель в лампах накаливания и в галогенных лампах, для легирования кремния в технологии полупроводниковых материалов Внимание !У вас нет прав для чтения и добавления комментариев. Пожалуйста авторизуйтесь или зарегистрируйтесь.Добавление комментария Есть что сказать? Пишите, нам всегда интересно знать Ваше мнение! Все вопросы по поводу данной новости оставляйте здесь, администрация и другие пользователи портала постараются Вам помочь. Пожалуйста, пишите комментарии без орфографических и пунктуационных ошибок. |
ЧасыОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



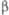 , град
, град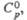 Дж/(моль· К)
Дж/(моль· К)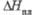 , кДж/
, кДж/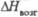 , кДж/
, кДж/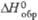 , кДж/
, кДж/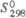 ,Дж/(моль· К)
,Дж/(моль· К)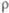 ,Ом· м
,Ом· м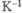
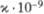
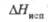
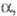 P III) образуется при
P III) образуется при 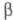 -модификацию
-модификацию
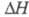 перехода
перехода 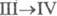 0,522 кДж/
0,522 кДж/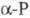 они
могут свободно вращаться, в
они
могут свободно вращаться, в 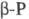 этого нет. Такие же
этого нет. Такие же 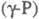 с плотн. 2,16 г/см3; при 360-450 0C -моноклинный
с плотн. 2,16 г/см3; при 360-450 0C -моноклинный 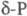 );
при ~ 500 0C - другая моноклинная модификация, также образующаяся
при нагр,
);
при ~ 500 0C - другая моноклинная модификация, также образующаяся
при нагр, 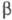 =107,4°. При длит. нагревании при ~ 600 0C образуется кубич.
=107,4°. При длит. нагревании при ~ 600 0C образуется кубич.

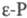 ).
Для перехода
).
Для перехода 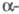 As
с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а
= 0,3524 нм,
As
с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а
= 0,3524 нм, 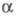 =57,25°).
При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а
= 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на
существование при высоких
=57,25°).
При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а
= 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на
существование при высоких 


 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0