Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Просмотров: 626
17.01.2012
ГАЛЛИЙ ГАЛЛИЙ (от Gallia-Галлия, лат. назв. Франции; лат. Gallium) Ga, хим. элемент III гр. периодич. системы, ат. н. 31, ат. м. 69,72. Прир. галлий состоит из изотопов 69Ga (61,2%) и 71Ga (38,8%), поперечное сечение захвата тепловых нейтронов соотв. 2,1*10-28 и 5,1*10-28 м2. Конфигурация внеш. электронной оболочки 4s24p1; степень окисления + 1 и +3; энергия ионизации Ga° -> Ga+ -> Ga2+ -> Ga3+ соотв. равна 5,998, 20,5144 и 30,66 эВ; электроотрицательность по Полингу 1,6; атомный радиус 0,139 нм; ионный радиус для Ga3 (в скобках указано координац. число) 0,061 нм (4), 0,069 нм (5) и 0,076 нм (6). Содержание галлия в земной коре 1,8*10-3 % по массе, в воде морей и океанов 3*10-5 мг/л. В природе встречается в виде чрезвычайно редких минералов - зенгеита Ga(OH)3, галлита CuGaS2 и др. Является спутником Al, Zn, Ge, Fe; содержится в сфалеритах (до 0,018% по массе), нефелине (среднее содержание 0,004%), натролите (до 0,1%), бокситах (среднее содержание 0,005%), германите (0,7-1,8%), алуните (0,001-0,06%), в углях и железных рудах нек-рых месторождений и др. Потенциальные мировые запасы галлия в бокситах св. 1 млн. т, в цинковых рудах ок. 10000 т.
Просмотров: 582
17.01.2012
ЦИНК ЦИНК (лат. Zincum), Zn, хим. элемент II гр. периодич. системы; ат. н. 30, ат. м. 65,39. Природный цинк состоит из 5 стабильных нуклидов: 64Zn (48,6%), 66Zn (27,9%), 67Zn (4,1%), 68Zn (18,8%) и 70Zn (0,6%). Известен ряд радиоактивных нуклидов, важнейший из них - 65Zn с Т1/2 244 сут. Конфигурация внеш. электронных оболочек атома 3d104s2; степень окисления + 2; энергия ионизации при последоват. переходе от Zn0 к Zn3+ 9,39, 17,96 и 39,70 эВ; сродство к электрону 0,09 эВ; электроотрицательность по Полингу 1,66; атомный радиус 0,139 нм, ионный радиус (в скобках указано коорди-нац. число) Zn2+ 0,060 нм (4), 0,068 нм (5), 0,0740 нм (6), 0,090 нм (8).Содержание цинка в земной коре 7-10-3 % по массе, в воде морей и океанов 0,01 мг/л. Известно более 70 минералов цинка, из них важнейшие: сфалерит (цинковая обманка) - кубич. модификация ZnS, его светлая разновидность - клейофан, черная - марматит; вюрцит (вюртцит) - гексагон. модификация ZnS; смитсонит ZnCO3; каламин Zn4(OH)2Si2O7 хH2O; цинкит ZnO; виллемит Zn2SiO4; франклинит ZnFe2O4. Минералы цинка обычно ассоциируются с минералами Рb и Сu в полиметаллич. рудах. Постоянные спутники цинка в рудах -рассеянные элементы - Cd, In, а также Ge, Ga, Tl.
Просмотров: 553
17.01.2012
МЕДЬ МЕДЬ (лат. Cuprum-от
назв. о. Кипр, где в древности добывали медную руду) Сu, хим. элемент I гр.
периодич. системы, ат. н. 29, ат. м. 63,546. Прир. медь состоит из смеси двух
стабильных изотопов 63Сu (69,09%) и 65Сu (30,91%). Поперечное
сечение захвата тепловых нейтронов для прир. смеси 3,77.10-28
м2. Конфигурация внеш. электронной оболочки атома 3d104s1;
степени окисления + 1, +2, редко +3, + 4; энергии ионизации Сu0 Содержание меди в земной
коре (4,7.5,5).10-3% по массе. Для меди характерны
месторождения гидротермального происхождения. В морской воде содержание меди 3.10-7%
по массе, в речной —1.10-7%; ионы меди, поступающие в бассейны
морей и океанов, сорбируются донными отложениями, поэтому содержание меди в них
достигает 5,7.10-3%. Ионы меди участвуют во многих физиол.
процессах, среднее содержание меди в живых организмах 2.10-4%
по массе, в крови человека ок. 0,001 мг/л.
Просмотров: 560
17.01.2012
НИКЕЛЬ НИКЕЛЬ (от нем. Nickel-имя
горного духа, по поверью, вводившего в заблуждение горняков; лат. Niccolum)
Ni, хим. элемент VIII гр. периодич. системы, ат. н. 28, ат. м. 58,69. Прир.
никель состоит из пяти изотопов; 58Ni (67,88%), 60Ni (26,23%),
61Ni (1,19%), 62Ni (3,66%) и 64Ni(l,04%). Конфигурация
внеш. электронных оболочек атома 3s23p63d84s2;
степени окисления + 2, редко + 1, +3 и +4; энергии ионизации Ni0
Среднее содержание никеля в
земной коре 8-10-3% по массе, в воде океанов 0,002 мг/л. Известно
ок. 50 минералов никеля, из них важнейшие: пентландит (Fe,Ni)9S8,
миллерит NiS, гарниерит (Ni,Mg)3Si4O10(OH)10.4H2O,
ревдинскит (не-пуит) (Ni,Mg)3Si2O5(OH)4,
никелин NiAs, аннабергит Ni3(AsO4)2•8Н2О.
В основном никель добывают из сульфидных медно-никелевых руд (Канада, Австралия,
Юж. Африка) и из силикатно-окисленных руд (Новая Каледония, Куба, Филиппины,
Индонезия и др.). Мировые запасы никеля на суше оцениваются в 70 млн. т.
Просмотров: 610
17.01.2012
Кобальт Кобальт (лат. Cobaltum), Со, химический элемент первой триады VIII группы периодической системы Менделеева; атомный номер 27, атомная масса 58,9332; тяжёлый металл серебристого цвета с розоватым отливом. В природе элемент представлен одним устойчивым изотопом 59Со; из полученных искусственно радиоактивных изотопов важнейший 60Со. Историческая справка. Окись кобальта применялась в Древнем Египте, Вавилоне, Китае для окрашивания стекол и эмалей в синий цвет. Для той же цели в 16 в. в Западной Европе стали пользоваться цафрой, или сафлором, — серой землистой массой, которая получалась при обжиге некоторых руд, носивших название «кобольд». Эти руды выделяли при обжиге обильный ядовитый дым, а из продукта их обжига выплавить металл не удавалось. Средневековые рудокопы и металлурги считали это проделками мифических существ — кобольдов (от нем. Kobold — домовой, гном). В 1735 шведский химик Г. Брандт, нагревая в горне с дутьём смесь цафры с углем и флюсом, получил металл, который назвал «корольком кобольда». Вскоре это название было изменено на «кобольт», а затем на «кобальт». Распространение в природе. Содержание кобальта в литосфере 1,8·10-3% по массе. В земной коре он мигрирует в магмах, горячих и холодных водах. При магматической дифференциации кобальт накапливается главным образом в верхней мантии: его среднее содержание в ультраосновных породах 2·10-2%. С магматическими процессами связано образование так называемых ликвационных месторождений кобальтовых руд. Концентрируясь из горячих подземных вод, кобальт образует гидротермальные месторождения; в них Со связан с Ni, As, S, Cu. Известно около 30 минералов кобальта (см. Кобальтовые руды). В биосфере кобальт преимущественно рассеивается, однако на участках, где есть растения — концентраторы кобальта, образуются кобальтовые месторождения. В верхней части земной коры наблюдается резкая дифференциация кобальта — в глинах и сланцах в среднем содержится 2·10-3% кобальта, в песчаниках 3·10-5, в известняках 1·10-5. Наиболее бедны кобальтом песчаные почвы лесных районов. В поверхностных водах кобальта мало, в Мировом океане его лишь 5·10-8%. Будучи слабым водным мигрантом, кобальт легко переходит в осадки, адсорбируясь гидроокисями марганца, глинами и др. высокодисперсными минералами.
Просмотров: 709
17.01.2012
ЖЕЛЕЗО ЖЕЛЕЗО (Ferrum) Fe, хим. элемент VIII гр. периодич. системы, ат. н. 26, ат. м. 55,847. Состоит из четырех стабильных изотопов: 54Fe (5,84%), 56Fe (91,68%), 57Fе (2,17%), 58Fe (0,31%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 2,62.10-28 м2.
Конфигурация внеш. электронных оболочек 3d64s2; степени окисления +2 и +3 (наиб. характерны), +1, +4, +6, +8; энергия ионизации при последоват. переходе от Fe0 к Fe5+ 7,893, 16,183, 30,65, 57,79 эВ; сродство к электрону 0,58 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,126 нм, ионные радиусы (в нм, в скобках указаны ко-ординац. числа) для Fe2+ 0,077 (4), 0,092 (6), 0,106 (8), для Fe3+ 0,063 (4), 0,079 (6), 0,092 (8).
Железо - один из самых распространенных элементов в
природе, его содержание в земной коре составляет 4,65% по массе.
Известно св. 300 минералов, из к-рых слагаются месторождения железных руд. Пром. значение имеют руды с содержанием Fe св. 16%. Важнейшие рудные минералы железа: магнетит (магнитный железняк) Fe3O4 (содержит 72,4% Fe), гематит (железный блеск, красный железняк) Fe2O3 (70% Fe), гётит a-FeO(OH), или Fe2O3.H2O, лепидокрокит g-FeO(OH) и гидрогётит (лимонит) Fe2O3.xH2O (ок. 62% Fe), сидерит FeCO3 (48,2% Fe), ильменит FeTiO3 (36,8% Fe). Наряду с полезными примесями - Mn, Cr, Ni, Ti, V, Co - железные руды содержат и вредные примеси - S, P и др. Железо входит в состав прир. силикатов, значительные скопления к-рых могут иметь пром. значение для произ-ва железа или его соед. Различают след. осн. типы железных руд.
Бурые железняки - руды гидроксидов Fe(III) (главный минерал - гётит); содержат до 66,1% Fe (чаще 30-55%); имеют осадочное происхождение. Крупнейшие месторождения в СССР, во Франции, в Гвинее. Гематитовые руды, или красные железняки (главный минерал - гематит); содержат обычно 50-65% Fe. Для них характерно залегание богатых руд
поверх мощных толщ бедных (30-40% Fe) магнетитовых кварцитов.
Крупнейшие месторождения в СССР, США, Канаде, Бразилии, Венесуэле.
Магнетитовые руды, или магнитные железняки (главный минерал -магнетит); содержат чаще всего до 45-60% Fe. Верх. горизонты магнетитовых рудных тел обычно частично окислены до гематита (полумартиты и мартиты). Крупнейшие месторождения в СССР и Швеции. Силикатные руды
(25-40% Fe) осадочного происхождения, используемые для выплавки чугуна в
ГДР, Югославии, ЧССР и ряде др. стран Европы, относятся к группе
зеленых слюд-хлоритов. Главные минералы - шамозит Fe4(Fe, Al)2[Al2Si2O10](OH)8 и тюрингит (Mg, Fe)3,5Al1,5[Si2,5Al1,5O10](ОН)6.nН2О - содержат до 42% Fe. Важнейшие месторождения в ГДР, Австрии и др.
Мировые разведанные запасы железных руд составляют 231,9 млрд. т, или 93 млрд. т в пересчете на железо (1980). По запасам железных руд (балансовым - св. 100 млрд. т) СССР занимает первое место в мире. Наиб. запасы железных руд (в млрд. т), кроме СССР, сосредоточены в Бразилии (34), Канаде (26), Австрии (21), США (17), Индии (13), ЮАР (9), Швеции (4,5) и во Франции (4).
Перспективно использование бедных железом горных пород и железомарганцевых конкреций. Мировые запасы последних оцениваются в 3000 млрд. т (1984).
Просмотров: 764
17.01.2012
МАРГАНЕЦ МАРГАНЕЦ (от нем. Manganerz - марганцевая руда; лат. Manganum) Mn, хим. элемент VII гр. периодич. системы, ат. н. 25, ат. м. 54,9380. В природе один устойчивый изотоп 55Мn. Конфигурация внеш. электронной оболочки атома 3d54s2, степени окисления от +2 до +7, наиб. устойчивы соед. Мn(II) и Mn(VII); энергии ионизации при последоват. переходе от Мn0 к Мn2+ соотв. равны 7,435 и 15,6401 эВ; элсктроотрицатсльность по Полингу 2,5; ионные радиусы (в скобках указаны координац. числа) Мn2+ 0,080 нм (4), 0,089 нм (5), 0,104 (7), Мn7+ 0,039 (4), 0,060 нм (6).
Содержание марганца в земной коре 0,1% по массе, в океанич. воде 2.10-7%. В своб. виде в природе не встречается. Входит в состав множества минералов, преим. типа оксидов. наиб. распространены пиролюзит b-МnО2, псиломелан mМО.nМnО2.хН2О [М = Ва, Са, К, Мn(II)], манганит b-MnOOH, браунит 3Мn2О3.MnSiO3, родохрозит МnСО3. Главные месторождения марганцевых руд (50-75% мировых
запасов, 1981) находятся в СССР. За рубежом крупнейшие месторождения известны в ЮАР (более 3 млрд. т, в пересчете на металл), Австралии (490 млн. т), Габоне (450 млн. т), Бразилии (100 млн. т), Индии (80 млн. т), Гане (10 млн. т). Общая мировая добыча марганцевых руд
20-25 млн. т/год. Большое кол-во марганца содержат железо-марганцевые
конкреции, расположенные в Тихом, Атлантическом и Индийском океанах; их
ресурсы в Тихом океане оцениваются в 90-1650 млрд. т.
Просмотров: 615
17.01.2012
ХРОМ ХРОМ (от греч. chroma - цвет, краска;
из-за яркой окраски соед.; лат. Chromium) Сг, хим. элемент VI гр. периодич.
системы, ат. н. 24, ат. м. 51,9961. Природный хром состоит из смеси 4 изотопов
50Сr
(4,35%), 52Сr (83,79%), 53Сr (9,50%) и 54Сr
(2,36%). Поперечное сечение захвата тепловых нейтронов для хрома 3,1 x 10-28
м2.
Просмотров: 527
17.01.2012
ВАНАДИЙ ВАНАДИЙ (от имени др.-сканд. богини красоты Ванадис, Vanadis; лат. Vanadium) V, хим. элемент V гр. периодич. системы, ат. н. 23, ат. м. 50,9415. Прир. ванадий состоит из стабильного изотопа 51V (99,76%) и слабо радиоактивного 50V (T1/2 1014 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 4,98*10-28 м2. Конфигурация внеш. электронной оболочки 3d34s2; степень окисления от + 2 до +5; энергия (эВ) ионизации при последоват. переходе от Vo к V5+ соотв. 6,74, 14,65, 29,31, 48,4, 65,2; электроотрицательность по Полингу 1,6; атомный радиус 0,134 нм, ионные радиусы (в скобках - координац. числа ванадия): V2+ 0,093 нм (6), V3+ 0,078 нм (6), V4+ 0,067 (5), 0,072 (6) и 0,086 нм (8), V5+ 0,050 (4), 0,060 (5) и 0,068 нм (6). Содержание ванадия в земной коре 1,9*10-2 % по массе (в почве -1,0*10-2 %), в воде океанов -3*10-7 %, золе растений - 6,1*10-3 %. Относится к рассеянным элементам. В своб. виде в природе не встречается. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl, деклуазит Pb(Zn, Cu)(VO4)(OH), моттрамит 5(Cu, Pb)O*V2O5*2H2O, тюямунит Ca(UO2)2(VO4)2*8H,O, карнотит K2(UO2)2(VO4)2*3H2O, роскоэлит KV2 [AlSi3O10](OH)2. В нек-рых магнетитовых, титаномагнетитовых и осадочных железных рудах и ванадийсодержащих фосфоритах содержится до 2,5-3,0% V2O5. Ванадий также присутствует в окисленных медно-свинцово-цинковых рудах (в виде минералов), высокосернистых нефтях (до 300 г в 1т), битуминозных сланцах, асфальтитах. Мировые запасы ванадия (без СССР) - 42 млн. т.
Просмотров: 601
17.01.2012
ТИТАН ТИТАН (Titanium)
Ti, хим. элемент IV гр. периодич. системы, ат.н. 22, ат. м. 47,88. В природе
пять стабильных изотопов: 46Ti (7,95%), 47Ti (7,75%),
48Ti (73,45%), 49Ti (5,51%), 50Ti (5,34%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 5,6·10-28м2.
Конфигурация внеш. электронных оболочек атома 3d24s2;
степени окисления + 4 (наиб. характерна), +3 и +2; энергия ионизации при последоват.
переходе от Ti0 к Ti4+ равна соотв. 6,82, 13,58,
27,47, 43,24 эВ; сродство к электрону 0,39 эВ; электроотрицательность по Полингу
1,5; атомный радиус 0,149 нм, ковалентный радиус 0,132 нм, ионные радиусы, нм
(в скобках указаны координац. числа) Ti4+ 0,056 (4), 0,065 (5), 0,0745
(6), 0,088 (8), Ti3+ 0,081 (6), Ti2+ 0,100 (6). Содержание титана в земной
коре 0,57% по массе. По распространенности в природе занимает 10-е место; в
своб. виде не встречается. Важнейшие минералы (известно св. 100): рутил ТiO2
(более редкие кристаллич. модификации - анатаз и брукит), ильменит FeTiO3,
титаномагнетит FeTiO3 + + Fe3O4, перовскит
СаТiO3 и титанит (сфен) CaTiOSiO4. Руды титана, имеющие пром. значение, разделяются на две осн. группы: коренные - ильменит-титано-магнетитовые; россыпные-рутил-ильменит-цирконовые. Крупные коренные месторождения ильменита и титаномагнетитов находятся в Канаде, США, Норвегии, Швеции, ЮАР, Египте, Индии, Австралии, СНГ. Общие запасы коренных месторождений оценивают в 600 млн. т по содержанию титана. Россыпные руды имеются в Бразилии, Индии, США, Сьерра-Леоне, Австралии.
|
ЧасыОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|



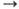 Сu+
Сu+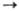 Сu2
+
Сu2
+  Сu3+
соотв. равны 7,7264, 20,2921, 36,83 эВ;
Сu3+
соотв. равны 7,7264, 20,2921, 36,83 эВ; 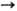 Ni+
Ni+
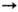 Ni2+
Ni2+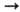 Ni3+
7,634, 18,153 и 35,17 эВ;
Ni3+
7,634, 18,153 и 35,17 эВ; 


 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0