Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
Сортировать по: Дате · Названию · Рейтингу · Комментариям · Просмотрам
Просмотров: 782
17.01.2012
СКАНДИЙ СКАНДИЙ (Scandium) Sc, хим. элемент III гр. периодич. системы, ат. н. 21, ат. м. 44,9559; относится к редкоземельным элементам. Известен один прир. стабильный изотоп 45Sc. Поперечное сечение захвата тепловых нейтронов 1,66·10-21 м2. Конфигурация внеш. электронных оболочек атома 3d14s2; устойчивая степень окисления + 3, редко + 1, + 2; энергии ионизации при последоват. переходе от Sc0 к Sc3+ равны соотв. 6,5616, 12,80 и 24,76 эВ; сродство к электрону — 0,73 эВ; электроотрицательность по Полингу 1,3; атомный радиус 0,164 нм, ионный радиус Sc3+ 0,089 нм (координац. число 6), 0,101 нм (8). Скандий-рассеянный литофильный элемент, геохимически близок РЗЭ иттриевой группы, Mg, Аl, Мh, Zr и Ti. Среднее содержание скандия в земной коре 1 · 10-3 % по массе, концентрация скандия в речных водах 4·10-8 г/л. подземных (2,2-5) x x 10-8 г/л, в воде океанов -8·10-10 г/л. Известно более 120 минералов-носителей скандия. Собств. минералы скандия (очень редки): тортвейтит (Sc,Y)2Si2O7, баццит Sc2Be3Si6Ol8, джервисит NaScSi2О6, каскандит CaScSi3O8(ОН), кольбекит (эггонит) ScPO4 · 2Н2 О
Просмотров: 865
17.01.2012
КАЛЬЦИЙ КАЛЬЦИЙ (от лат. calx, род. падеж calcis - известь; лат. Calcium), Са, хим. элемент II гр. периодич. системы, относится к щелочноземельным элементам, ат. н. 20, ат. м. 40,08. Прир. кальций состоит из шести стабильных изотопов - 40Са (96,94%), 44Са (2,09%), 42Са (0,667%), 48Са (0,187%), 43Са (0,135%) и 46Са (0,003%). Поперечные сечения (10-28 м2) захвата тепловых нейтронов изотопов с маc. ч. 40, 42, 44, 46 и 48 равны соотв. 0,22, 40, 0,63, 0,25 и 1,1. Конфигурация внеш. электронной оболочки 4s2; степень окисления +2, очень редко +1; энергии ионизации Са0 : Са+ : Са2+ соотв. равны 6,11308 и 11,8714 эВ; электроотрицательность по Полингу 1,0; атомный радиус 0,197 нм, ионный радиус (в скобках указано координац. число) Са2+ 0,114 нм (6), 0,126 нм (8), 0,137 нм (10), 0,148 нм (12). По распространенности в земной коре кальций занимает пятое место (после О, Si, Al, Fe), его содержание в земной коре составляет 3,38% по массе. Встречается только в виде соед., в основном солей кислородсодержащих к-т; известно ок. 400 минералов, содержащих кальций. Очень распространены разл. силикаты и алюмосиликаты, напр., анортит Са[Al2Si2O8], диопсид CaMg[Si2O6], волластонит Са3[Si3O9]. Кроме них пром. значение имеют кальцит СаСО3 (прир. формы - известняк, мел, мрамор), доломит CaMg(CO3)2, фосфорит Са5(РО4)3(ОН, СО3) (с разл. примесями), апатиты Са5(PO4)3(F, Cl), гипс CaSO4.2H2O, флюорит CaF2 и др. Большое кол-во кальция находится в прир. водах вследствие существования глобального карбонатного равновесия между практически нерастворимым СаСО3, хорошо р-римым Са(НСО3)2 и находящимся в воде и воздухе СО2. Значительное кол-во кальция содержится в организмах мн. животных, напр., гидроксилапатит - в костной ткани позвоночных, СаСО3 - в раковинах моллюсков, яичной скорлупе.
Просмотров: 707
17.01.2012
КАЛИЙ КАЛИЙ (от араб. аль-кали - поташ; лат. Kalium) К, хим. элемент I гр. периодич. системы; относится к щелочным металлам, ат. н. 19, ат. м. 39,0983. Состоит из двух стабильных изотопов 39К (93,259%) и 41К (6,729%), а также радиоактивного изотопа 40К (Т1/2 1,32.109 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 1,97.10-28 м2. Конфигурация внеш. электронной оболочки 4s1; степень окисления +1; энергия ионизации К0 : К+ : К2+ соотв. 4,34070 эВ и 31,8196 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,8; атомный радиус 0,2313 нм, ионный радиус (в скобках указано координац. число) К+ 0,151 нм (4), 0,152 нм (6), 0,160 нм (7), 0,165 нм (8), 0,178 нм (12). Содержание в земной коре 2,41% по массе. Осн. минералы: сильвин КСl, карналлит KCl.MgCl2.6H2O, калиевый полевой шпат (ортоклаз) K[AlSi3O8], мусковит калиевая слюда) KAl2[AlSi3O10](OH, F)2, каинит КСl.MgSO4.3H2O, полигалит K2SO4.MgSO4.2CaSO4.2Н2О, алунит KAl3(SO4)2(OH)6.
Просмотров: 669
17.01.2012
КРЕМНИЙ КРЕМНИЙ (Silicium) Si, химический элемент IV гр. периодич. системы, ат. н. 14, ат. м. 28,0855. Состоит из трех стабильных изотопов 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). Поперечное сечение захвата тепловых нейтронов 1,3.10-29 м2. Конфигурация внеш. электронной оболочки 3s23p2; степень окисления +4 (наиб. устойчива), +3, +2 и +1; энергии ионизации при последоват. переходе от Si° к Si4+ соотв. 8,1517, 16,342, 33,46 и 45,13 эВ; сродство к электрону 1,22 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,133, ионный радиус Si4+ (в скобках указаны координац. числа) 0,040 нм (4), 0,054 нм (6), ковалентный - 0,1175 нм.
Кремний-второй после кислорода
по распространенности в земной коре элемент (27,6% по массе). В своб.
состоянии в природе не встречается, находится преим. в виде SiO2 (см. Кремния диоксид) или силикатов. В виде SiO2 кремний входят в состав растит. и животных организмов (напр., скелетные части).
Просмотров: 564
17.01.2012
АЛЮМИНИЙ АЛЮМИНИЙ (от лат. alumen, род. падеж aluminis - квасцы; лат.
Aluminium) A1, хим. элемент III гр. периодич. системы, ат. н. 13, ат. м.
26,98154. В природе один стабильный изотоп 27А1. Поперечное
сечение захвата тепловых нейтронов 215*10-25 м2.
Конфигурация внеш. электронной оболочки 3s23p; степень окисления
+ 3, менее характерны + 1 и + 2 (только выше 800 °С в газовой фазе); энергия
ионизации Аl0 -> А1+ -> А12 +
-> А13+ соотв. 5,984, 18,828, 28,44 эВ; сродство к электрону
0,5 эВ; электроотрицательность по Полингу 1,5; атомный радиус 0,143 нм,
ионный радиус А13+ (в скобках указаны координац. числа) 0,053
нм (4), 0,062 нм (5), 0,067 нм (6).
Содержание алюминия в земной коре 8,8% по массе. По распространенности в природе занимает четвертое место среди всех элементов (после О, Н и Si) и первое среди металлов; в своб. виде не встречается. Важнейшие минералы: боксит, представляющий собой смесь гидроксидов алюминия - диаспора и бемита А1ООН и гиббсита (гидраргиллита) А1(ОH)3 (крупнейшие месторождения в Австралии, Бразилии, Гвинее и на Ямайке; пром. месторождения имеются также в СФРЮ, Греции, ВНР, Франции и СССР); алунит, или квасцовый камень (Na, К)2 * SO4*A12(SO4)3*4A1(OH3) (осн. месторождения в СССР, ЧССР, Италии); нефелин (Na,K)2O*Al2O3*2SiO2 (осн. месторождения в СССР, Гренландии, Норвегии, Швеции, Кении).
Просмотров: 622
17.01.2012
МАГНИЙ МАГНИЙ (Magnesium) Mg, хим. элемент II гр. периодич. системы, ат. н. 12, ат. м. 24,305; относится к щелочноземельным элементам. Прир. магний состоит из трех стабильных изотопов 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 5,9.10-20 м2. Конфигурация внеш. электронной оболочки 3s2; степень окисления +2, очень редко +1; энергии ионизации Mg0 : Mg+ : Mg2+ равны соотв. 7,64607 и 15,0353 эВ; электроотрицательность по Полингу 1,2; сродство к электрону -0,22 эВ; атомный радиус 0,160 нм, ионные радиусы для Mg2+ (в скобках указаны координац. числа) 0,071 нм (4), 0,08 нм (5), 0,086 нм (6), 0,103 нм (8).
Содержание магния в земной коре 2,35% по массе. Встречается в природе только в виде соединений. Известно более 100 минералов, содержащих магний; большинство из них - силикаты и алюмосиликаты, напр. оливин (Mg,Fe)2[SiO4], серпентин Mg6(OH)8[Si4O10] и др. Образуют залежи пром.
значения гл. обр. магнезит MgCO3, доломит MgCO3.СаСО3, асбест, бишофит MgCl2.6H2O, карналлит KCl.MgCl2.6H2O, кизерит MgSO4.H2O, эпсомит MgSO4.7H2O, каинит KCl.MgSO4.3H2O, астраханит Na2SO4.MgSO4.4H2O. Запасы хлоридных калийно-магниевых солей сосредоточены в СССР, ГДР, ФРГ, Испании, США, карбонатных минералов - в ЧССР, СФРЮ, КНР, Австрии, Греции и др. Много магния содержится в воде морей и океанов и в прир. рассолах. Магний всегда содержится в растениях, т.к. входит в состав молекулы хлорофилла.
Просмотров: 526
17.01.2012
НАТРИЙ НАТРИЙ (от араб.
натрун, греч. nitron - природная сода; лат. Natrium) Na, хим. элемент I гр.
периодич. системы, ат. н. 11, ат.м. 22,98977; относится к щелочным металлам.
В природе один стабильный изотоп 23Na. Поперечное сечение захвата
тепловых нейтронов 4,90.10-25 м2. Конфигурация
внеш. электронной оболочки 3s1; степень окисления +1; энергии ионизации
Na0 Содержание натрия в земной
коре 2,64% по массе. В гидросфере натрий содержится в виде растворимых солей в кол-ве
ок. 2,9% (при общей концентрации солей в морской воде 3,5-3,7%); содержание
натрия в морской воде 1,5.1016 т. Наличие натрия установлено в
атмосфере Солнца и межзвездном пространстве. В природе натрий находится только в
виде солей. Важнейшие минералы-галит (каменная соль) NaCl, мирабилит (глауберова
соль) Na2SO4•10 Н2О, тенардит Na,SO4,
чилийская селитра NaNO3, криолит Na3[AlF6],
трона NaHCO3•Na2CO3•2Н2О, бура (тинкал)
Na2B4O7•10Н2О, а также прир. силикаты,
напр. альбит Na[AlSi3O8], нефелин Na [AlSiO4],
содержащие помимо натрия и др. элементы. Соед. натрия входят в состав живых организмов,
гл. обр. в виде NaCl. Так, напр., в плазме крови человека содержание ионов натрия 0,32% по массе, в костях-0,6%, в мышечных тканях-0,6-1,5%. Для восполнения естеств. убыли натрия из организма человек ежедневно должен употреблять с пищей 4-5 г NaCl.
Просмотров: 545
17.01.2012
БЕРИЛЛИЙ БЕРИЛЛИЙ (от греч. beryllion - уменьшит. от beryllos - берилл;
лат. Beryllium) Be, хим. элемент II гр. периодич. системы, ат. н. 4, ат.
м. 9,01218. В природе встречается только один стабильный изотоп 9Ве.
Поперечное сечение захвата тепловых нейтронов 0,90*10-30 м2,
поперечное сечение рассеяния нейтронов 7,54*10-28 м2.
Конфигурация внеш. электронной оболочки 2s2; степени окисления
+2, + 1 (крайне неустойчива); энергия ионизации Ве° -> Be1+
->Ве2+ соотв. 9,3227 и 18,2112 эВ; электроотрицательность по
Полингу 1,5; атомный радиус 0,113 нм; ионный радиус Be2+ 0,030
нм (координац. число 3).
Содержание бериллия в земной коре 6*10-4% по массе, в воде морей и океанов 6*10-7 мг/л. Известно 54 собственно бериллисвых минерала, важнейшие из них - берилл (и его разновидности - изумруд, аквамарин, гелиодор, воробьевит, ростерит, бандит) 3ВеО*А12О3*6SiO2 (14,0% ВеО), фенакит 2BeO*SiO2 (45,5% ВеО), бертрандит 4ВеО*2SiO2*Н2О (36,5% ВеО), гельвин (Mn,Fe,Zn)4[BeSiO4]3S (11,0-14,2% ВеО). Общие запасы бериллия в рудах (в виде берилла и бертрандита) - 380 тыс. т (1980).
Просмотров: 829
17.01.2012
ЛИТИЙ ЛИТИЙ (от греч. lithos - камень; лат. Lithium) Li, хим. элемент I гр. периодич. системы, относится к щелочным металлам, ат. н. 3, ат. м. 6,941. Состоит из двух стабильных изотопов 6Li (7,52%) и 7Li (92,48%), для к-рых поперечное сечение захвата тепловых нейтронов составляет соотв. 9,45.10-26м2 и 3,3.10-30м2 (для прир. смеси изотопов 6,7 - 7,1.10-27 м2). Конфигурация внеш. электронной оболочки 2s1; степень окисления +1; энергия ионизации Li° : Li + 5,39178 эВ; сродство к электрону 0,591 эВ; электроотрицательность по Полингу 0,95; ат. радиус 0,157 нм, ионный радиус Li+ (в скобках приведены координац. числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8).
Содержание лития в земной коре 6,5.10-3% по массе. Осн. минералы: сподумен LiAl[Si2O6], лепидолит KLi1,5Al1,5[Si3AlO10](F,OH)2 и петалит (Li,Na)[Si4AlO10].
Перспективные источники сырья для произ-ва лития - межзернистая рапа
соленосных отложений (41% мировых экзогенных запасов) и подземные воды (до 10 мг/л). Общие запасы Li2O в недрах и водах зарубежных стран, кроме вод Мирового океана, составляют ок. 24 млн. т. наиб. крупные разведанные месторождения пром. руд находятся в СССР, США, Канаде, Чили, Зимбабве, Бразилии и Намибии.
|
ЧасыОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|



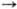 Na+
Na+  Na2+
5,13915 и 47,304 эВ;
Na2+
5,13915 и 47,304 эВ; 


 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0