Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
V. Физическая химия 1 часть
Просмотров: 891
18.01.2012
V. ФИЗИЧЕСКАЯ ХИМИЯ1. Основные понятия термодинамикиТермодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды. Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы). Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы. Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела. Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом. Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией. Параметры состояния – величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы. Термодинамический процесс – всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния). Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Равновесный процесс – процесс, при котором система проходит через непрерывный ряд состояний, бесконечно близких к состоянию равновесия. Характерные особенности равновесного процесса: 1) бесконечно малая разность действующих и противодействующих сил: Fex – Fin → 0; 2) совершение системой в прямом процессе максимальной работы |W| = max; 3) бесконечно медленное течение процесса, связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний t → ∞. Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать обратимо или необратимо. Несамопроизвольный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы. Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве. Внутренняя энергия системы U – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как ее полную энергию за вычетом кинетической и потенциальной энергии системы как целого. [U] = Дж. Теплота Q – форма передачи энергии путем неупорядоченного движения молекул, путем хаотических столкновений молекул двух соприкасающихся тел, т. е. путем теплопроводности (и одновременно путем излучения). Q > 0, если система получает теплоту из окружающей среды. [Q] = Дж. Работа W – форма передачи энергии путем упорядоченного движения частиц (макроскопических масс) под действием каких-либо сил. W > 0, если окружающая среда совершает работу над системой. [W] = Дж. Вся работа делится на механическую работу расширения (или сжатия) и прочие виды работы (полезная работа): δW = —pdV + δW′. Стандартное состояние твердых и жидких веществ – устойчивое состояние чистого вещества при данной температуре под давлением р = 1атм. Стандартное состоянии чистого газа – состояние газа, подчиняющееся уравнению состояния идеального газа при давлении 1 атм. Стандартные величины – величины, определенные для веществ, находящихся в стандартном состоянии (обозначаются надстрочным индексом 0). 1.1. Первое начало термодинамикиЭнергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях. Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких-либо более общих положений. Первое начало термодинамики устанавливает соотношение между теплотой Q, работой W и изменением внутренней энергии системы ΔU. Изолированная система Внутренняя энергия изолированной системы остается постоянной. U = const или dU = 0Закрытая система Изменение внутренней энергии закрытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой. ΔU =Q +W или dU = δQ + δWОткрытая система Изменение внутренней энергии открытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой, а также за счет изменения массы системы. ΔU =Q +W + ΔUm или dU = δQ + δW + iΣUidniВнутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях: ΔU =U2 – U1Для некоторого процесса: ΔU = Σ(viUi)npoд – Σ(viUi)исх1.2. Применение первого начала термодинамики к гомогенным однокомпонентным закрытым системамИзохорный процесс (V = const; ΔV = 0)В простейшем случае – полезная работа не совершается. dU = δQ + δW = δQ – pdVdU = δQv = CVdT = nCVdTВсе количество теплоты, полученное системой, идет на изменение внутренней энергии. 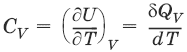
– теплоемкость при постоянном объеме, т. е. количество теплоты, необходимое для повышения температуры системы на один градус при постоянном объеме. [СV] = Дж/град. ĈV – мольная теплоемкость при постоянном объеме, Дж/(моль × град). Для идеальных газов: ĈV = 2/3R – одноатомный газ; ĈV = 5/2R – двухатомный газ. Изобарный процесс (Р = const)dU = δQ + δW = δQ – pdVδQp = dU + pdV = d(U + pV) = dHH = U + pV – энтальпия – функция состояния системы. ΔН = Σ(νiUi)прод – Σ(νiUi)исхδQp = dU + pdV =dH = CpdT – тепловой эффект изобарного процесса равен изменению энтальпии системы. 
– теплоемкость при постоянном давлении. [С] = Дж/град. Ĉр – мольная теплоемкость при постоянном давлении, Дж/(моль × град). Для идеальных газов: Ĉр = ĈV + R; Ĉр, ĈV = [Дж/(моль • К)]. Тепловой эффект (теплота) химической реакции – количество теплоты, выделившейся либо поглотившейся в ходе реакции при постоянной температуре. Qv = ΔUVQp = ΔUpЗависимость теплового эффекта реакции от температуры. Закон КирхгоффаТемпературный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции. Закон Кирхгоффа: 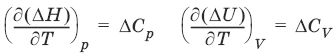
Для химического процесса изменение теплоемкости задается изменением состава системы: ΔСр = Σ(νiCp,i)прод – Σ(νiCp,i)исх или ΔCV = Σ(νiCV,i)прод – Σ(νiCV,i)исхИнтегральная форма закона Кирхгоффа: ΔНТ2 = ΔНТ1 + ΔСр(Т2 – T1) или ΔUT2 = ΔUTi + ΔСV(Т2 – T1)1.3. Второе начало термодинамики. Энтропия1) Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. 2) Невозможен процесс, единственным результатом которого является превращение теплоты в работу. 3) Существует некоторая функция состояния системы, названная энтропией, изменение которой следующим образом связано с поглощаемой теплотой и температурой системы: в неравновесном процессе 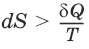
в равновесном процессе 
S – энтропия, Дж/град, 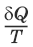
– приведенная теплота. Статистическая интерпретация энтропииКаждому состоянию системы приписывается термодинамическая вероятность (определяемая как число микросостояний, составляющих данное макросостояние системы), тем большая, чем более неупорядоченным или неопределенным является это состояние. Энтропия – функция состояния, описывающая степень неупорядоченности системы. S = klnW – формула Больцмана. Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью. Расчет абсолютной энтропии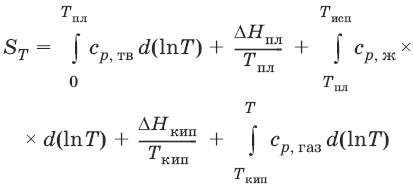
Изменение энтропии в ходе химического процесса определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути реакции: ΔS = Σ(νiSi)прод – Σ(νiSi)исхВеличины абсолютной энтропии в стандартных условиях приведены в справочной литературе. 1.4. Термодинамические потенциалыПотенциал – величина, убыль которой определяет производимую системой работу. Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения. F = U – TS – свободная энергия Гельмгольца – изохорно-изотермический потенциал (Дж) – определяет направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях. dF = dU – TdS или ΔF = ΔU – TΔSG = H – TS = U + pV – TS – свободная энергия Гиббса – изобарно-изотермический потенциал (Дж) – определяет направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изобарно-изотермических условиях. dG = dH – TdS или ΔG = ΔН – TΔSΔG = Σ(νiGi)прод – Σ(νiGi)исхΔG0 = Σ(νiΔGобр0)прод – Σ(νiΔGобр0)исхУсловия самопроизвольного протекания процессов в закрытых системахИзобарно-изотермические (Р = const, Т = const): ΔG < 0, dG < 0Изохорно-изотермические (V = const, Т = const): ΔF < 0, dF < 0Термодинамическим равновесием называется такое термодинамическое состояние системы с минимальной свободной энергией, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом. Условия термодинамического равновесия в закрытой системеИзобарно-изотермические (Р = const, Т = const): ΔG = 0, dG = 0, d 2G > 0Изохорно-изотермические (V = const, Т = const): ΔF = 0, dF = 0, d 2F > 0Уравнения изотермы химической реакции:Для реакции v1A1 + v2A2 + … = v′1B1 + v′2B2 + … 
Здесь Ci,pi – концентрации, давления реагирующих веществ в любой момент времени, отличный от состояния равновесия. Влияние внешних условий на химическое равновесиеПринцип смещения равновесия Ле Шателье-Брауна Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие. Влияние температуры на положение равновесия
Экзотермические реакции: ΔН° < 0 (ΔU° < 0). Повышение температуры уменьшает величину константы равновесия, т. е. смещает равновесие влево. Эндотермические реакции: ΔН° > 0 (ΔU° > 0). Повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо). 2. Фазовые равновесияКомпонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне ее. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними. Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Правило фаз Дж. Гиббса: Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие: С = К – Ф + n. Для системы, на которую из внешних факторов влияют только температура и давление, можно записать: С = К – Ф + 2. Принцип непрерывности – при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы. Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния. 2.1. Диаграмма состояния водыК = 1. В системе возможны три фазовых равновесия: между жидкостью и газом (линия ОА), твердым телом и газом (линия ОВ), твердым телом и жидкостью (линия OC). Три кривые имеют точку пересечения О, называемую тройной точкой воды, – отвечают равновесию между тремя фазами и С = 0; три фазы могут находиться в равновесии лишь при строго определенных значениях температуры и давления (для воды тройная точка отвечает состоянию с Р = 6,1 кПа и Т = 273,16 К). 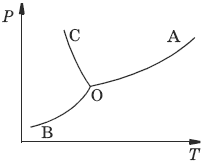
Внутри каждой из областей диаграммы (АОВ, ВOC, АOC) система однофазна; С = 2 (система бивариантна). На каждой из линий число фаз в системе равно двум, и, согласно правилу фаз, система моновариантна: С = 1 – 2 + 2 = 1, т. е. для каждого значения температуры имеется только одно значение давления. Влияние давления на температуру фазового перехода описывает уравнение Кла-узиуса – Клапейрона: 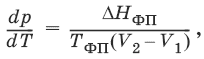
V 2, V1 – изменение молярного объема вещества при фазовом переходе. Кривая равновесия «твердое вещество – жидкость» на диаграмме состояния воды наклонена влево, а на диаграммах состояния остальных веществ – вправо, т. к. плотность воды больше, чем плотность льда, т. е. плавление сопровождается уменьшением объема (AV < 0). В этом случае увеличение давления будет понижать температуру фазового перехода «твердое тело – жидкость» (вода – аномальное вещество). Для всех остальных веществ (т. н. нормальные вещества) ΔVпл > 0 и, согласно уравнению Клаузиуса-Клапейрона, увеличение давления приводит к повышению температуры плавления. 3. Свойства растворов3.1. Термодинамика растворовРаствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения ее свойств. Диффузия в растворах Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе за счет теплового движения его молекул или атомов. Закон Фика: количество вещества, диффундирующее за единицу времени через единицу площади поверхности пропорционально градиенту его концентрации: 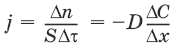
где j – диффузионный поток; D – коэффициент диффузии. Уравнение Эйнштейна-Смолуховского: 
где η – вязкость среды; R – радиус диффундирующих частиц. Растворимость газов в газахЗакон Дальтона: общее давление газовой смеси равно сумме парциальных давлений всех входящих в нее газов: Робщ = Σpi и pi = xiРобщЗакон Генри-Дальтона: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью: Ci = kpi, где Ci – концентрация раствора газа в жидкости; k – коэффициент пропорциональности, зависящий от природы газа. Как правило, при растворении газа в жидкости выделяется теплота (к < 0), поэтому с повышением температуры растворимость уменьшается. Формула Сеченова: X =Х0е-kСэлгде X и Х0 – растворимость газа в чистом растворителе и растворе электролита с концентрацией С. 3.2. Коллигативные свойства растворов неэлектролитовКоллигативными (коллективными) называются свойства растворов относительно свойств растворителя, зависящие главным образом от числа растворенных частиц. Давление насыщенного пара разбавленных растворовПар, находящийся в равновесии с жидкостью, называется насыщенным. Давление такого пара р0 называется давлением или упругостью насыщенного пара чистого растворителя. Первый закон Рауля. Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом: pi = pi0 xiДля бинарного раствора, состоящего из компонентов А и В: относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества: 
Растворы, для которых выполняется закон Рауля, называют идеальными растворами. Давление пара идеальных и реальных растворов
Если компоненты бинарного (состоящего из двух компонентов) раствора летучи, то пар над раствором будет содержать оба компонента. Общее Состав, мол. доли в (хв) давление пара: p = pA0xA + pB0xB = pA0(1 – xB) + pB0xB = pA0 – xB(pA0 – pB0)
Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения, ΔН тв > 0). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения, ΔHраств < 0). Температура кристаллизации разбавленных растворовВторой закон Рауля. Понижение температуры замерзания раствора ΔТзам прямо пропорционально моляльной концентрации раствора: ΔTзам = Т0 – Т = КСm, где Т0 – температура замерзания чистого растворителя; Т – температура замерзания раствора; К – криоскопическая постоянная растворителя, град/кг моль, 
Т02 – температура замерзания растворителя; М – молекулярная масса растворителя, ΔНпл – мольная теплота плавления растворителя. Температура кипения разбавленных растворовТемпература кипения – температура, при которой давление насыщенного пара становится равным внешнему давлению. Повышение температуры кипения растворов нелетучих веществ ΔТК = Тк – Тк0 пропорционально понижению давления насыщенного пара и прямо пропорционально моляльной концентрации раствора: ΔТкип = ЕСm, где Е – эбулиоскопическая постоянная растворителя, град/кг • моль, 
Осмотическое давление разбавленных растворовОсмос – преимущественно одностороннее прохождение молекул растворителя через полупроницаемую мембрану в раствор или молекул растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, численно равно осмотическому давлению π (Па). Принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор: π = CRT. Изотонические растворы – два раствора с одинаковым осмотическим давлением (π1 = π2). Гипертонический раствор – раствор, осмотическое давление которого больше, чем у другого (π1 > π2). Гипотонический раствор – раствор, осмотическое давление которого меньше, чем у другого (π1 < π2). 3.3. Растворы электролитовСтепень диссоциации α – отношение числа молекул n, распавшихся на ионы, к общему числу молекул N: 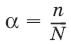
Изотонический коэффициент i Ван-Гоффа – отношение фактического числа частиц в растворе электролита к числу частиц этого раствора без учета диссоциации. Если из N молекул продиссоциировало n, причем каждая молекула распалась на ν ионов, то 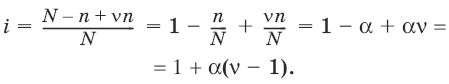
Для неэлектролитов i = 1. Для электролитов 1 < i ≤ ν. 3.4. Коллигативные свойства растворов электролитов:
Теория электролитической диссоциации Аррениуса1. Электролиты в растворах распадаются на ионы – диссоциируют. 2. Диссоциация является обратимым равновесным процессом. 3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т. е. растворы являются идеальными). Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0,7), средней силы (0,3 < α < 0,7) и слабые (α ≤ 0,3). Слабые электролиты. Константа диссоциацииДля некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением: АаВb ↔ аАx- + bВy+
Для бинарного электролита: 
Для разбавленных растворов можно считать, что (1 – α) = 1 и К ≈ α2С. 
– закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального: а = fC; а+ = f+С+; а_ = f_C_.Для бинарного электролита: 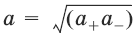
– средняя активность электролита; 
– средний коэффициент активности. Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ½, где z – заряд иона, для которого рассчитывается коэффициент активности; I – ионная сила раствора I = 0,5Σ(Сiri2). 4. Электропроводность растворов электролитовПроводники I рода – металлы и их расплавы, в которых электричество переносится электронами. Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости. Электрический ток есть упорядоченное перемещение заряженных частиц. Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2: 
Величина W, обратная сопротивлению, называется электропроводностью – количественной меры способности раствора электролита проводить электрический ток. 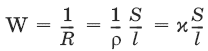
Удельная электропроводность χ(к) – электропроводность проводника I рода длиной 1 м с площадью поперечного сечения 1 м2 или электропроводность 1 м3 (1 см3) раствора электролита (проводника II рода) при расстоянии между электродами 1 м (1 см) и площади электродов 1 м2 (1 см2). 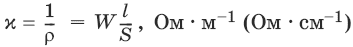
Молярная электропроводность раствора) λ – электропроводность раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. 
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т. е. с увеличением разведения раствора V = 1/C), достигая некоторого предельного значения λ0(λ∞), называемого молярной электропроводностью при бесконечном разведении. Для бинарного электролита с однозарядными ионами при постоянной температуре и напряженности поля 1 В • м-1: λ = αF(u + + и¯),где F – число Фарадея; и+, и¯ – абсолютные подвижности (м2В-1с-1) катиона и аниона – скорости движения данных ионов в стандартных условиях, при разности потенциалов в 1В на 1 м длины раствора. λ+ = Fu+; λ¯ = Fu¯,где λ+, λ¯ – подвижности катиона и аниона, Ом • м2 • моль-1 (Ом • см2 • моль-1). λ = α(λ+ + λ¯)Для сильных электролитов α ≈1 и λ = λ+ + λ¯ При бесконечном разбавлении раствора (V → ∞, λ+ → λ∞+, λ¯ → λ∞¯, α → 1) как для сильного, так и для слабого электролитов λ∞ = λ∞+ – λ∞¯ – закон Кольрауша: молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей λ∞+, λ∞¯ катиона и аниона данного электролита. Ионы Н+ и OH¯ обладают аномально высокой подвижностью, что связано с особым механизмом переноса заряда этими ионами – эстафетным механизмом. Между ионами гидроксония Н3O+ и молекулами воды, а также между молекулами воды и ионами OH¯ непрерывно происходит обмен протонами по уравнениям: Н3O+ + Н2O → Н2O + Н3O+ Н2O + OH¯ → OH¯ + Н2O
Внимание !У вас нет прав для чтения и добавления комментариев. Пожалуйста авторизуйтесь или зарегистрируйтесь.Добавление комментария Есть что сказать? Пишите, нам всегда интересно знать Ваше мнение! Все вопросы по поводу данной новости оставляйте здесь, администрация и другие пользователи портала постараются Вам помочь. Пожалуйста, пишите комментарии без орфографических и пунктуационных ошибок. |
ЧасыОнлайнОнлайн всего: 4 Гостей: 4 Пользователей: 0
|
||||






 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0