Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
IV. Органическая химия 1 часть
Просмотров: 1776
18.01.2012
IV. Органическая химия1. АлканыАлканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы СnH2n+2. В соответствии с общей формулой алканы образуют гомологический ряд. Первые четыре представителя имеют полусистематические названия – метан (CH4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса -ан: пентан (С5Н12), гексан (С6Н14), гептан (С7Н16) и т. д. Атомы углерода в алканах находятся в sp3-гибридном состоянии. Оси четырех sp3-орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 . Пространственное строение метана: 
Энергия С—С связи Ес—с = 351 кДж/моль, длина С—С связи 0,154 нм. Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная. Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам. 
Способы получения алканов1. СnH2n+2 →400–700 °C→ СpH2p+2 + СmH2m, n = m + p. Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). 
(гидрирование непредельных соединений) 3. nCO + (2n + 1)Н2 → СnH2n+2 + nH2O (получение из синтез-газа (CO + Н2)) 4. (реакция Вюрца) 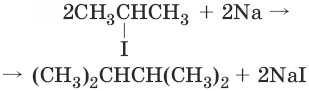
5. (реакция Дюма) CH3COONa + NaOH →t→ CH4 + Na2CO3 6. (реакция Кольбе) 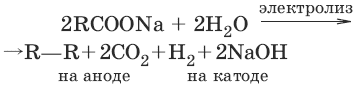
Химические свойства алкановАлканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации. 1. (реакционная способность убывает в ряду: F2 > Cl2 > Br2 > (I2 не идет), R3C• > R2CH• > RCH2• > RCH3•) 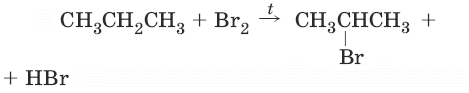
2. (реакция Коновалова) 
3. CnH2n+2 + SO2 + ½O2 →hν→ CnH2n+1SO3H – алкилсульфокислота (сульфоокисление, условия реакции: облучение УФ) 4. CH4 →1000 °C→ С + 2Н2; 2CH4 →t>1500 °C→ С2Н2 + ЗН2 (разложение метана – пиролиз) 5. CH4 + 2Н2O →Ni, 1300 °C→ CO2 + 4Н2 (конверсия метана) 6. 2СnH2n+2 + (Зn+1)O2 → 2nCO2 + (2n+2)Н2O (горение алканов) 7. 2н-С4Н10 + 5O2 → 4CH3COOH + 2Н2O (окисление алканов в промышленности; получение уксусной кислоты) 8. н-С4Н10 → изо-С4Н10 (изомеризация, катализатор AlCl3) 2. ЦиклоалканыЦиклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью. Общая формула СnH2n. Атомы углерода в циклоалканах, как и в алканах, находятся в sp3-гибридизованном состоянии. Гомологический ряд циклоалканов начинает простейший циклоалкан – циклопропан С3Н6, представляющий собой плоский трехчленный карбоцикл. По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т. д.). 

Структурная изомерия циклоалканов связана с различной величиной цикла (структуры 1 и 2), строением и видом заместителей (структуры 5 и 6) и их взаимным расположением (структуры 3 и 4). 
Способы получения циклоалканов1. Получение из дигалогенопроизводных углеводородов 
2. Получение из ароматичесих углеводородов 

Химические свойства циклоалкановХимические свойства циклоалканов зависят от размера цикла, определяющего его устойчивость. Трех– и четырехчленные циклы (малые циклы), являясь насыщенными, резко отличаются от всех остальных предельных углеводородов. Циклопропан, циклобутан вступают в реакции присоединения. Для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения. 1. Действие галогенов 

2. Действие галогеноводородов 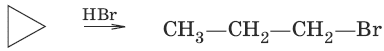
С циклоалканами, содержащими пять и более атомов углерода в цикле, галогеново-дороды не взаимодействуют. 3. 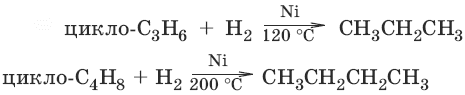
4. Дегидрирование 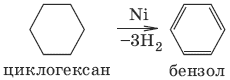
3. АлкеныАлкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов СnН2n. По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – ан на – ен: этан (CH3—CH3) – этен (CH2=CH2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. В молекуле алкена ненасыщенные атомы углерода находятся в sp2-гибридизации, а двойная связь между ними образована σ– и π-связью. sp2-Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р-орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей. Пространственное строение этилена: 
Длина связи С=С 0,134 нм, энергия связи С=С Ес=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль. Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans) – изомерия, вид пространственной изомерии. Способы получения алкенов1. CH3—CH3 →Ni, t→ CH2=CH2 + H2 (дегидрирование алканов) 2. С2Н5OH →H,SO4, 170 °C→ CH2=CH2 + Н2O (дегидратация спиртов) 3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева) 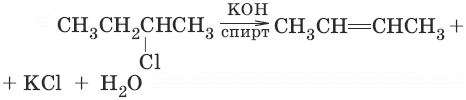
4. CH2Cl—CH2Cl + Zn → ZnCl2 + CH2=CH2 (дегалогенирование дигалогенопроизводных) 5. HC≡CH + Н2 →Ni, t→ CH2=CH2 (восстановление алкинов) Химические свойства алкеновДля алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются. 1. CH2=CH2 + Br2 → CH2Br—CH2Br (присоединение галогенов, качественная реакция) 2. (присоединение галогеноводородов по правилу Марковникова) 
3. CH2=CH2 + Н2 →Ni, t→ CH3—CH3 (гидрирование) 4. CH2=CH2 + Н2O →H+→ CH3CH2OH (гидратация) 5. ЗCH2=CH2 + 2КMnO4 + 4Н2O → ЗCH2OH—CH2OH + 2MnO2↓ + 2KOH (мягкое окисление, качественная реакция) 6. CH2=CH—CH2—CH3 + КMnO4 →H+→ CO2 + С2Н5COOH (жесткое окисление) 7. CH2=CH—CH2—CH3 + O3 → Н2С=O + CH3CH2CH=O формальдегид+пропаналь → (озонолиз) 8. С2Н4 + 3O2 → 2CO2 + 2Н2O (реакция горения) 9. (полимеризация) 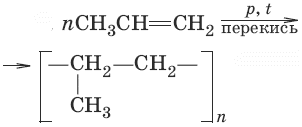
10. CH3—CH=CH2 + HBr →перекись→ CH3—CH2—CH2Br (присоединение бро-моводорода против правила Марковникова) 11. (реакция замещения в α-положение) 
4. АлкиныАлкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С≡С связь. Общая формула алкинов с одной тройной связью СnН2n-2. Простейший представитель ряда алкинов CH≡CH имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на -ин: этан (CH3—CH3) – этин (CH≡CH) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. В образовании тройной связи участвуют атомы углерода в sp-гибридизованном состоянии. Каждый из них имеет по две sp-гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных p-орбитали, расположенных под углом 90° по отношению друг к другу и к sp-гибридным орбиталям. Пространственное строение ацетилена: 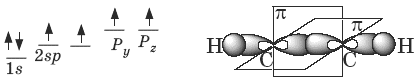
Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами. Способы получения алкинов1. СаО + ЗС →t→ СаС2 + CO; СаС2 + 2Н2O → Са(OH)2 + CH≡CH (получение ацетилена) 2. 2CH4 →t>1500 °C→ HC = CH + ЗН2 (крекинг углеводородов) 3. CH3—CHCl2 + 2KOH →в спирте → HC≡CH + 2KCl + Н2O (дегалогенирова-ние) CH2Cl—CH2Cl + 2KOH →в спирте → HC≡CH + 2KCl + Н2O Химические свойства алкиновДля алкинов характерны реакции присоединения, замещения. Алкины полиме-ризуются, изомеризуются, вступают в реакции конденсации. 1. (гидрирование) 
2. HC≡CH + Br2 → CHBr=CHBr; CHBr=CHBr + Br2 → CHBr2—CHBr2 (присоединение галогенов, качественная реакция) 3. CH3—С≡CH + HBr → CH3—CBr=CH2; CH3—CBr=CH2 + HBr → CH3—CBr2—CHg (присоединение галогеноводородов по правилу Марковникова) 4. (гидратация алинов, реация Кучерова) 

5.(присоединение спиртов) 
6.(присоединение карбоновых ислот) 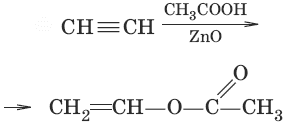
7. CH≡CH + 2Ag2O →NH3→ AgC≡CAg↓ + H2O (образование ацетиленидов, качественная реакция на концевую тройную связь) 8. CH≡CH + [О] →КMnO4→ HOOC—COOH → HCOOH + CO2 (окисление) 9. CH≡CH + CH≡CH → CH2=CH—С≡CH (катализатор – CuCl и NH4Cl, димеризация) 10. 3HC≡CH →C, 600 °C→ С6Н6 (бензол) (циклоолигомеризация, реакция Зелинского) 5. Диеновые углеводородыАлкадиены (диены) – непредельные углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnН2n_2. Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. Способы получения диенов1. (метод СВ. Лебедева) 
2. (дегидратация) 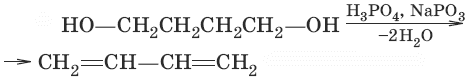
3. (дегидрирование) 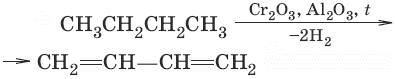
Химические свойства диеновДля сопряженных диенов характерны реакции присоединения. Сопряженные диены способны присоединять не только по двойным связям (к C1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода с образованием двойной связи между С2 и С3. 

6. Ароматические углеводородыАрены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах. Все связи С—С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы). 
формула КекулеГомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5—R, R—С6Н4—R. Общая формула гомологического ряда бензола СnН2n_6 (n > 6). Для названия ароматических углеводородов широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень): С6Н5—CH3 (метилбензол), С6Н5—С2Н5 (этилбензол). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Для дизамещен-ных бензолов R—С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто– (o-) – заместители соседних атомов углерода кольца (1,2-); мета– (м-) – заместители через один атом углерода (1,3-); пара– (п-) – заместители на противоположных сторонах кольца (1,4-). 
Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п-ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С2Н5. Способы получения ароматических углеводородов1. С6Н12 →Pt, 300 °C→ С6Н6 + ЗН2 (дегидрирование циклоалканов) 2. н-С6Н14 →Cr2O3, 300 °C→ С6Н6 + 4Н2 (дегидроциклизация алканов) 3. ЗС2Н2 →С, 600 °C→ С6Н6 (циклотримеризация ацетилена, реакция Зелинского) Химические свойства ароматических углеводородовПо химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом. 1. C6H6 + Cl2 →AlCl3→ C6H5Cl + HCl (галогенирование) 2. C6H6 + HNO3 →H2SO4→ C6H5—NO2 + H2O (нитрование) 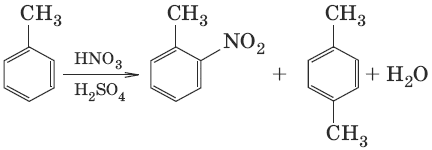
3. С6Н6 →H2SO4→ С6Н5—SO3H + H2O (сульфирование) 4. С6Н6 + RCl →AlCl3→ С6Н5—R + HCl (алкилирование) 5. (ацилирование) 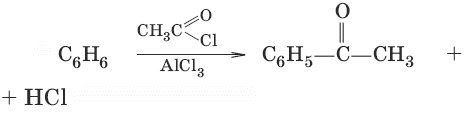
6. С6Н6 + ЗН2 →t, Ni→ С6Н12 циклогексан (присоединение водорода) 7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора) 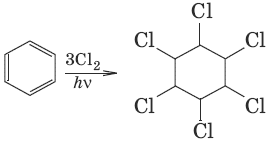
8. С6Н5—CH3 + [О] → С6Н5—COOH кипячение с раствором КMnO4 (окисление алкилбензолов) 7. ГалогеноуглеводородыГалогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена. Способы получения галогеноуглеводородов1. CH2=CH2 + HBr → CH3—CH2Br (гидрогалогенирование ненасыщенных углеводородов) CH≡CH + HCl → CH2=CHCl 2. CH3CH2OH + РCl5 → CH3CH2Cl + POCl3 + HCl (получение из спиртов) CH3CH2OH + HCl → CH3CH2Cl + Н2O (в присутствии ZnCl2, t°C) 3. а) CH4+ Cl2 →hv→ CH3Cl + HCl (галогенирование углеводородов) б) 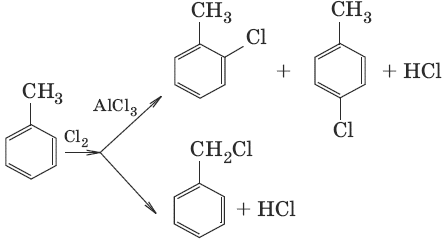
Химические свойства галогеноуглево-дородовНаибольшее значение для соединений этого класса имеют реакции замещения и отщепления. 1. CH3CH2Br + NaOH (водн. р-р) → CH3CH2OH + NaBr (образование спиртов) 2. CH3CH2Br + NaCN → CH3CH2CN + NaBr (образование нитрилов) 3. CH3CH2Br + NH3 → [CH3CH2NH3]+Br ↔—HBr↔ CH3CH2NH2 (образование аминов) 4. CH3CH2Br + NaNO2 → CH3CH2 NO2 + NaBr (образование нитросоединений) 5. CH3Br + 2Na + CH3Br → CH3—CH3 + 2NaBr (реакция Вюрца) 6. CH3Br + Mg → CH3MgBr (образование магнийорганических соединений, реактив Гриньяра) 7. (дегидрогалогенирование) 
8. СпиртыСпиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (—OH), связанных с насыщенными атомами углерода. Группа —OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа —OH), многоатомные (две и более групп —OH). Одноатомные спирты: метанол CH3OH, этанол С2Н5OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO—CH2—CH2—OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO—CH2—CH(OH)—CH2—OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R—CH2—OH, вторичные R2CH—OH, третичные R3C—OH. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH3CH2—OH), непредельные, или алкенолы (CH2=CH—CH2—OH), ароматические (С6Н5CH2—OH). Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С3); 2) углеродного скелета (начиная с С4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH3CH2OH и диметиловый эфир CH3—О—CH3). Следствием полярности связи О—Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей. Способы получения спиртов1. CH2=CH2 + Н2O/Н+ → CH3—CH2OH (гидратация алкенов) 2. CH3—CHO + Н2 →t, Ni→ С2Н5OH (восстановление альдегидов и кетонов) 3. C2H5Br + NaOH (водн.) → С2Н5OH + NaBr (гидролиз галогенопроизводных) ClCH2—CH2Cl + 2NaOH (водн.) → HOCH2—CH2OH + 2NaCl 4. CO + 2Н2 →ZnO, CuO, 250 °C, 7 МПа→ CH3OH (получение метанола, промышленность) 5. С6Н12O6 →дрожжи→ 2С2Н5OH + 2CO2 (брожение моноз) 6. 3CH2=CH2 + 2KMnO4 + 4Н2O → 3CH2OH—CH2OH - этиленгиликоль + 2KOH + 2MnO2 (окисление в мягких условиях) 7. а) CH2=CH—CH3 + O2 → CH2=CH—CHO + Н2O б) CH2=CH—CHO + Н2 → CH2=CH—CH2OH в) CH2=CH—CH2OH + Н2O2 → HOCH2—CH(OH)—CH2OH (получение глицерина) Химические свойства спиртовХимические свойства спиртов связаны с наличием в их молекулу группы —OH. Для спиртов характерны два типа реакций: разрыв связи С—О и связи О—Н. 1. 2С2Н5OH + 2Na → Н2 + 2C2H5ONa (образование алкоголятов металлов Na, К, Mg, Al) 2. а) С2Н5OH + NaOH ≠ (в водном растворе не идет) б) CH2OH—CH2OH + 2NaOH → NaOCH2—CH2ONa + 2Н2O в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди) 
3. а) (образование сложных эфиров) 
б) С2Н5OH + H2SO4 → С2Н5—О—SO3H + Н2O (на холоду) в) 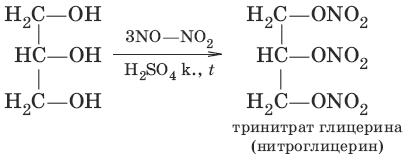
4. а) С2Н5OH + HBr → С2Н5Br + Н2O б) С2Н5OH + РCl5 → С2Н5Cl + POCl3 + HCl в) С2Н5OH + SOCl2 → С2Н5Cl + SO2 + HCl (замещение гидроксильной группы на галоген) 5. С2Н5OH + HOC2H5 →H2SO4, <140 °C→ C2H5—O—C2H5 + H2O (межмолекулярная гидротация) 6. С2Н5OH →H2SO4, 170 °C→ CH2=CH2 + H2O (внутримолекулярная гидротация) 7. а) (дегидрирование, окисление первичных спиртов) 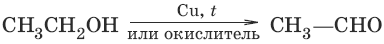
б) (дегидрирование, окисление вторичных спиртов) 
Внимание !У вас нет прав для чтения и добавления комментариев. Пожалуйста авторизуйтесь или зарегистрируйтесь.Добавление комментария Есть что сказать? Пишите, нам всегда интересно знать Ваше мнение! Все вопросы по поводу данной новости оставляйте здесь, администрация и другие пользователи портала постараются Вам помочь. Пожалуйста, пишите комментарии без орфографических и пунктуационных ошибок. |
ЧасыОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|
||||






 Всего: 91
Всего: 91  Новых за месяц: 0
Новых за месяц: 0