Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
Просмотров: 514
17.01.2012
НАТРИЙ НАТРИЙ (от араб.
натрун, греч. nitron - природная сода; лат. Natrium) Na, хим. элемент I гр.
периодич. системы, ат. н. 11, ат.м. 22,98977; относится к щелочным металлам.
В природе один стабильный изотоп 23Na. Поперечное сечение захвата
тепловых нейтронов 4,90.10-25 м2. Конфигурация
внеш. электронной оболочки 3s1; степень окисления +1; энергии ионизации
Na0 Содержание натрия в земной
коре 2,64% по массе. В гидросфере натрий содержится в виде растворимых солей в кол-ве
ок. 2,9% (при общей концентрации солей в морской воде 3,5-3,7%); содержание
натрия в морской воде 1,5.1016 т. Наличие натрия установлено в
атмосфере Солнца и межзвездном пространстве. В природе натрий находится только в
виде солей. Важнейшие минералы-галит (каменная соль) NaCl, мирабилит (глауберова
соль) Na2SO4•10 Н2О, тенардит Na,SO4,
чилийская селитра NaNO3, криолит Na3[AlF6],
трона NaHCO3•Na2CO3•2Н2О, бура (тинкал)
Na2B4O7•10Н2О, а также прир. силикаты,
напр. альбит Na[AlSi3O8], нефелин Na [AlSiO4],
содержащие помимо натрия и др. элементы. Соед. натрия входят в состав живых организмов,
гл. обр. в виде NaCl. Так, напр., в плазме крови человека содержание ионов натрия 0,32% по массе, в костях-0,6%, в мышечных тканях-0,6-1,5%. Для восполнения естеств. убыли натрия из организма человек ежедневно должен употреблять с пищей 4-5 г NaCl.
Просмотров: 607
17.01.2012
НЕОН НЕОН (от греч. neos-новый;
лат. Neon) Ne, хим. элемент VIII гр. периодич. системы; относится к благородным
газам; ат. н. 10, ат.м. 20,179. Природный неон состоит из изотопов 20Ne
(90,92% по объему), 21Ne (0,257%), 22Ne (8,82%). Поперечное
сечение захвата тепловых нейтронов для прир. смеси изотопов не более 2,8.10-28
м2. Известны коротко-живущие (T1/2 < 200 с) изотопы
неона. Конфигурация внеш. электронной оболочки атома 2s22p6;
энергия ионизации Ne0 Содержание неона в атмосфере 1,82.10-3% по объему, в земной коре 7•10-5 г/т; запасы неона оцениваются в 7,8.1014 м3. Неон представлен в горячих звездах-красных гигантах, газовых туманностях, атмосфере Юпитера, Сатурна, Урана. Нептуна, Плутона. Считают, что в космосе преобладает 20Ne.
Просмотров: 758
17.01.2012
ФТОР ФТОР (отгреч. phthoros
- разрушение; лат. Fluorum) F, хим. элементVП гр. периодич. системы, относится
к галогенам; ат. н. 9, ат. м. 18,998403. Прир. фтор состоит из одного стабильного
нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1 ·10-31
м2. Конфигурация внеш. электронной оболочки атома 2s22p5
степень окисления -1; энергии ионизации при последоват. переходе от F0
к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868
кДж/моль; сродство к электрону 327,8 кДж/моль. Фтор- самый электроотрицат. элемент,
его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны
координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6).
Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия
гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением. Молекула своб. фтора двухатомна,
межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению
с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль). Содержание фтора в земной коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал, имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения к-рого встречаются на всех континентах, а наиб. запасы сосредоточены в США, Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание фтора в пром. рудах CaF2 122, в перспективных - 236 млн. т (1984, без СССР). В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане, в Забайкалье, Приморском крае и др
Просмотров: 779
17.01.2012
КИСЛОРОД КИСЛОРОД (лат Oxygenium, от греч.
oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы,
ат. н. 8, ат. м. 15,9994. Прир. кислород состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18О (0,204%]. Конфигурация внеш. электронной оболочки атома 2s22p; энергии ионизации О°:О+:О2+ равны соотв. 13,61819, 35,118 эВ; электроотрицательность по Полингу 3,5 (наиб. электроотрицат. элемент после F); сродство к электрону 1,467 эВ; ковалентный радиус 0,066 нм.
Молекула кислорода двухатомна. Существует также аллотропная модификация кислорода озон О3. Межатомное расстояние в молекуле О2 0,12074 нм; энергия ионизации О2 12,075 эВ;
сродство к электрону 0,44 эВ; энергия диссоциации 493,57 кДж/моль, константа диссоциации Кр=pO2/pO2 составляет 1,662.10-1 при 1500 К, 1,264.10-2 при 3000 К, 48,37 при 5000 К; ионный радиус О2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное 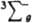 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему кислород парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему кислород парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 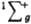 (энергия возбуждения 156,8 кДж/моль).
Кислород-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. кислорода, в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 минералов, в состав к-рых входит кислород. Убыль кислорода в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением кислорода растениями при фотосинтезе. Кислород входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%. (энергия возбуждения 156,8 кДж/моль).
Кислород-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. кислорода, в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного кислорода. Известно более 1400 минералов, в состав к-рых входит кислород. Убыль кислорода в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением кислорода растениями при фотосинтезе. Кислород входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Просмотров: 921
17.01.2012
АЗОТ АЗОТ (от греч. а--приставка, здесь означающая отсутствие, и 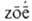 -жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6). -жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
Молекула азота двухатомна, связь между атомами тройная (длина 0,110 нм). Энергия термич. диссоциации молекулы велика (941,64 кДж/моль), поэтому диссоциация становится заметной лишь при очень высоких т-рах. Так, при 3000°С и нормальном давлении диссоциирована лишь 0,1% молекул. Общее содержание азота в земной коре 1*10-2 % по массе. Наиб. часть азота находится в своб. состоянии в атмосфере (азот - главная составная часть воздуха: 75,6% по массе или 78,09% по объему). В связанном состоянии азот встречается в воздухе, в водах рек, морей и океанов. В земной коре он образует три осн. типа минералов, содержащих ионы CN-, NO3- и NH+4. Пром. значение имеет натриевая (чилийская) селитра NaNO3, крупные залежи к-рой находятся в Чили; в сравнительно больших кол-вах встречается калиевая (индийская) селитра KNO3. В виде нейтральных и ионизир. атомов, а также в виде соед. [NO, (CN)2, NH3] азот обнаружен в составе газовых облаков комет, в туманностях и в атмосфере Солнца. Азот входит в состав всех живых организмов. В небольших кол-вах содержится в каменном угле (1,0-2,5%) и нефти (0,2-1,7%). Велико значение азота в жизнедеятельности растений и животных: в белках его до 17%, в организме человека в целом ок. 3%.
Просмотров: 604
17.01.2012
УГЛЕРОД УГЛЕРОД
(Carboneum) C, хим. элемент IV гр. периодич. системы, ат. н. 6, ат.м. 12.011.
Природный углерод состоит из двух стабильных изотопов - 12C (98,892%)
и 13C (1,108%). Сечение захвата тепловых нейтронов 3,5·10-31
м2. В атмосфере присутствует радиоактивный нуклид 14C.
Он постоянно образуется в ниж. слоях стратосферы в результате воздействия нейтронов
космич. излучения на ядра азота по р-ции: 14N (n, р)14C.
Конфигурация внеш. электронной оболочки атома углерода 2s22p2;
степени окисления +4, -
4, редко +2 (СО, карбонилы металлов), +3 (C2N2, галоген-цианы);
сродство к электрону 1,27 эВ; энергий ионизации при последоват. переходе от
С° к C4+ соотв. 11,26040, 24,383, 47,871 и 64,19 эВ; электроотрицательность
по Полингу 2,5; атомный радиус 0,077 нм, ионный радиус C4+ (в скобках
даны координац. числа) 0,029 нм (4), 0,030 нм (6). Содержание углерода в земной коре 0,48% по массе. Свободный углерод находится в природе в виде алмаза и графита. Осн. масса углерода встречается в виде карбонатов природных (известняки и доломиты), горючих ископаемых - антрацит (94-97% С), бурые угли (64-80% С), каменные угли (76-95% С), горючие сланцы (56-78% С), нефть (82-87% С), газы природные горючие (до 99% CH4), торф (53-62% С), а также битумы и др. В атмосфере и гидросфере углерод находится в виде углерода диоксида CO2, в воздухе 0,046% CO2 по массе, в водах рек, морей и океанов в ~ 60 раз больше. Углерод входит в состав растений и животных (~18%). Кругооборот углерода в природе включает биол. цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива, из вулканич. газов, горячих минер. источников, из поверхностных слоев океанич. вод и др. Биол. цикл состоит в том, что углерод в виде CO2 поглощается из тропосферы растениями, затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растит, материалов - в почву и в виде CO2 - в атмосферу.
Просмотров: 680
17.01.2012
БОР БОР (от позднелат. borax - бура; лат. Borum) В, хим. элемент III гр. периодич. системы, ат. н. 5, ат. м. 10,811. Прир. бор состоит из двух стабильных изотопов - 10В (19,57%) и 11В (80,43%). Поперечное сечение захвата тепловых нейтронов 10B 3*10-25 м2, 11В 4*10-32 м2. Конфигурация внеш. электронной оболочки 2s22р; степень окисления + 3, редко + 2; энергия ионизации при последоват. переходе от В° к В5+ соотв. 8,29811, 25,156, 37,92, 259,30 и 340,13 эВ; атомный радиус 0,097 нм, ковалентный 0,088 нм, металлический 0,091 нм, ионный В3+ 0,025 нм (координац. число 4). Содержание бора в земной коре 5*10-3% по массе, в воде океанов - 4,6 мг/л. В природе в своб. виде не встречается. Важнейшие минералы - бура Na2B4O7*10Н2О, кернит Na2B4O7*4HaO. На земной пов-сти бор мигрирует и концентрируется в рассолах озер и морей. Главные осадочные бо-ратные месторождения находятся в СССР, США, ГДР. Мировые запасы бора ок. 100 млн. т.
Просмотров: 534
17.01.2012
БЕРИЛЛИЙ БЕРИЛЛИЙ (от греч. beryllion - уменьшит. от beryllos - берилл;
лат. Beryllium) Be, хим. элемент II гр. периодич. системы, ат. н. 4, ат.
м. 9,01218. В природе встречается только один стабильный изотоп 9Ве.
Поперечное сечение захвата тепловых нейтронов 0,90*10-30 м2,
поперечное сечение рассеяния нейтронов 7,54*10-28 м2.
Конфигурация внеш. электронной оболочки 2s2; степени окисления
+2, + 1 (крайне неустойчива); энергия ионизации Ве° -> Be1+
->Ве2+ соотв. 9,3227 и 18,2112 эВ; электроотрицательность по
Полингу 1,5; атомный радиус 0,113 нм; ионный радиус Be2+ 0,030
нм (координац. число 3).
Содержание бериллия в земной коре 6*10-4% по массе, в воде морей и океанов 6*10-7 мг/л. Известно 54 собственно бериллисвых минерала, важнейшие из них - берилл (и его разновидности - изумруд, аквамарин, гелиодор, воробьевит, ростерит, бандит) 3ВеО*А12О3*6SiO2 (14,0% ВеО), фенакит 2BeO*SiO2 (45,5% ВеО), бертрандит 4ВеО*2SiO2*Н2О (36,5% ВеО), гельвин (Mn,Fe,Zn)4[BeSiO4]3S (11,0-14,2% ВеО). Общие запасы бериллия в рудах (в виде берилла и бертрандита) - 380 тыс. т (1980).
Просмотров: 818
17.01.2012
ЛИТИЙ ЛИТИЙ (от греч. lithos - камень; лат. Lithium) Li, хим. элемент I гр. периодич. системы, относится к щелочным металлам, ат. н. 3, ат. м. 6,941. Состоит из двух стабильных изотопов 6Li (7,52%) и 7Li (92,48%), для к-рых поперечное сечение захвата тепловых нейтронов составляет соотв. 9,45.10-26м2 и 3,3.10-30м2 (для прир. смеси изотопов 6,7 - 7,1.10-27 м2). Конфигурация внеш. электронной оболочки 2s1; степень окисления +1; энергия ионизации Li° : Li + 5,39178 эВ; сродство к электрону 0,591 эВ; электроотрицательность по Полингу 0,95; ат. радиус 0,157 нм, ионный радиус Li+ (в скобках приведены координац. числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8).
Содержание лития в земной коре 6,5.10-3% по массе. Осн. минералы: сподумен LiAl[Si2O6], лепидолит KLi1,5Al1,5[Si3AlO10](F,OH)2 и петалит (Li,Na)[Si4AlO10].
Перспективные источники сырья для произ-ва лития - межзернистая рапа
соленосных отложений (41% мировых экзогенных запасов) и подземные воды (до 10 мг/л). Общие запасы Li2O в недрах и водах зарубежных стран, кроме вод Мирового океана, составляют ок. 24 млн. т. наиб. крупные разведанные месторождения пром. руд находятся в СССР, США, Канаде, Чили, Зимбабве, Бразилии и Намибии.
Просмотров: 589
17.01.2012
ГЕЛИЙ ГЕЛИЙ (от греч. helios-солнце; лат. Helium) He, хим. элемент VIII гр. периодич. системы, ат. н. 2, ат. м. 4,002602; относится к благородным газам. Атмосферный гелий состоит из изотопов 3Не (0,00013% по объему) и 4Не. Поперечное сечение захвата тепловых нейтронов для 4Не 68*10-32 м2, для 3Не-54*10-26 м2. Конфигурация электронной оболочки 1s2; энергия ионизации Не0 -> Не+ -> Не2 + соотв. 2372 и 5250 кДж/моль; ван-дер-ваальсов радиус 0,122 нм, ковалентный радиус 0,04-0,06 нм. Гелий-один из наиб. распространенных элементов космоса-занимает второе
место после водорода. Содержание гелия в атмосфере (образуется в результате |
ЧасыТоп пользователей
ОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|



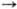 Na+
Na+  Na2+
5,13915 и 47,304 эВ;
Na2+
5,13915 и 47,304 эВ; 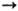 Ne+
Ne+
 Ne+2
соотв. 2080,66 и 3963,52 кДж/
Ne+2
соотв. 2080,66 и 3963,52 кДж/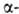 распада
Ac, Th, U) 5,27*10-4% по объему. Запасы гелия в
распада
Ac, Th, U) 5,27*10-4% по объему. Запасы гелия в 


 Всего: 91
Всего: 91  Новых за месяц: 1
Новых за месяц: 1