Добро пожаловать на наш портал
На нашем сайте ежедневно публикуются десятки качественных и свежих материалов, которые Вы можете скачать абсолютно бесплатно. Рекомендуем Вам добавить Наш сайт в закладки, а также подписаться на RSS ленту, чтобы не пропускать интересных новостей.




Перевести страницуМини-чатОпрос |
II. Неорганическая химия 2 часть
Просмотров: 1323
18.01.2012
6. VA-группaЭлементы VA-группы имеют электронную формулу ns2nps. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2O5 имеют кислотные свойства, свойства оксидов Э2O3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi. 6.1. Получение и свойства азота и его соединенийХарактерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице. 
Простое вещество NH4NO2 →t→ N2 + 2H2O N2 + 6Li = 2Li3N N2 + 3Ca →t→ Ca3N2 N2 + O2 →t→ 2NO Соединения азота (-3) N2 + ЗН2 →t, p, катализатор→ 2NH3 Ca3N2 + 6H2O = ЗСа(OH)2 + 2NH3 2NH4Cl + Са(OH)2 →t→ CaCl2 + 2NH3 + 2Н2O NH3 + Н2O ↔ NH3 • Н2O ↔ NH4+ + OH¯ NH3 + HCl = NH4Cl 4NH3 + CuSO4 = [Cu(NH3)4]SO4 2NH3 • H2O + AgCl = [Ag(NH3)2]Cl + 2H2O 4NH3 • H2O + Ag2O = 2[Ag(NH3)2]OH + 3H2O 4NH3 + 3O2 = 2N2 + 6H2O 4NH3 + 5O2 →Pt, t→ 4NO + 6H2O 2NH3 + 3CuO →t→ 3Cu + N2 + 3H2O NH4Cl + NaOH = NaCl + NH3 + H2O NH4Cl →t→ NH3 + HCl NH4NO2 →t→ N2 + 2H2O (NH4)2CO3 →t→ 2NH3 + H2O + CO2 NH4NO3 →t→ N2O + 2H2O NH4NO2 →t→ N2 + 2H2O (NH4)2Cr2O7 →t→ N2 + Cr2O3 + 4H2O Оксиды азота 2N2O →t→ 2N2 + O2 2HNO2 = NO2 + NO + H2O 2NO2 + Н2O(хол.) = HNO2 + HNO3 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O 3NO2 + H2O(rop.) = 2HNO3 + NO 4NO2 + O2 + 2H2O = 4HNO3 N2O3 = NO + NO2 2N2O5 = 2NO2 + O2 N2O5 + H2O = 2HNO3 N2O5 + 2NaOH = 2NaNO3 + H2O Соединения азота (+3) Ba(NO2)2 + H2SO4(разб.) = BaSO4↓ + 2HNO2 (на холоду) NO2 + NO + H2O = 2HNO2 (на холоду) 2HNO2 = NO2 + NO + H2O 2HNO2 + 2HI = I2 + 2NO + 2H2O 5NaNO2 + 3H2SO4 + 2KMnO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O 2NaNO2 + 2H2SO4 + 2KI = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O Соединения азота (+5) N2 + 3H2 →t, p, катализатор→ 2NH3 4NH3 + 5O2 →Pt, t→ 4NO + 6H2O 2NO + O2 = 2NO2 4NO2 + O2 + 2H2O = 4HNO3 NaNO3 + H2SO4(конц.) = HNO3 + NaHSO4 4HNO3 →hv → 4NO2 + O2 + 2H2O Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O 4Ca + 10HNO3(конц.) = 4Ca(NO3)2 + N2O + 5H2O 4Са + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O HNO3(конц.) пассивирует на холоду Al, Fe, Cr. Fe + 6HNO3 (конц.) →t→ Fe(NO3)3 + 3NO2 + 3H2O Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO + 2H2O ЗР + 5HNO3(разб.) + 2Н2O = 3H3PO4 + 5NO S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 3H2O 2KNO3 →t→ 2KNO2 + O2 (металлы до Mg в ряду напряжений) 2Cu(NO3)2 →t→ 2CuO + 4NO2 + O2 (металлы от Mg до Cu) 2AgNO3 →t→ 2Ag + 2NO2 + O2 (металлы после Cu в ряду напряжений) 4Fe(NO3)2 →t→ 2Fe2O3 + 8NO2 + O2 6.2. Получение и свойства фосфора и его соединенийПростое вещество (Р4 – белый фосфор, Р – красный фосфор) 2Са3(PO4)2 + 10C + 6SiO2 →t→ Р4 + 6CaSiO3 + 10CO 4Р + 5O2 →t→ Р4О10 Р4 + 6Са →t→ 2Са3Р2 Фосфин РН3 Zn3P2 + 6HCl = 2PH3↑ + 3ZnCl2 Са3Р2 + 6Н2O = 2PH3↑ + 3Ca(OH)2 2РН3 + 2O2 = Н3PO4 РН3 + HI= PH4I (на холоду) Фосфористая кислота Н3PO3 (Н2РHO3 – двухосновная кислота) Р4O6 + 6Н2O = 4Н3PO3 Н3PO3 + NaOH = NaH2PO3 + H2O (NaHPHO3 – кислая соль) Н3PO3 + 2NaOH = Na2HPO3 + H2O (Na2PHO3 – средняя соль) Фосфорные кислоты: метафосфорная НPO3 (Нn(PO3)n, где n = 3, 4), дифосфорная – Н4Р2O7, ортофосфорная – Н3PO4. Р4 + 5O2 = Р4О10 Р4О10 →Н2O, 0 °C→ НPO3 →Н2O, 20 °C→ Н4Р2O7 →Н2O, 10 °C→ Н3PO4 Н3PO4 →t→ Н4Р2O7 →t→ НPO3 Н3PO4 + NH3 = NH4H2PO4 Н3PO4 + NaOH = NaH2PO4 + H2O Н3PO4 + 2NaOH = Na2HPO4 + 2H2O Н3PO4 + 3NaOH = Na3PO4 + 3H2O Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 Са3(PO4)2 + 2H2SO4 = Са(Н2PO4)2 + 2CaSO4 2Са3(PO4)2 + 10C + 6SiO2 →t→ Р4 + 6CaSiO3 + 10CO 7. VIA-группаVIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns2np4. Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d-орбитали, поэтому его валентность равна двум. Наличие d-орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть. 7.1. Кислород и его соединенияКислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице. 
Получение и свойства кислорода Кислород может быть получен при сжижении и разделении воздуха. 2КMnO4 →t→ К2MnO4 + MnO2 + O2 2KClO3 →t→ 2KCl + 3O2 (NaOH) + 2Н2O →электролиз раствора→ 2Н2 + O2 O2 + 2F2 = OF2 2Са + O2 = 2СаО S + O2 = SO2 2С2Н2 + 5O2 = 4CO2 + 2Н2O 4FeS2 + 11O2 →t→ 2Fe2O3 + 8SO2 4NH3 + 3O2 = 6Н2O + 2N2 4NH3 + 5O2 →p, t, Pt→ 4NO + 6Н2O Получение и свойства озона O3 3O2 →hv→ 2O3 O3 = O2 + О KI + Н2O + O3 = I2 + 2KOH + O2 Свойства пероксида водорода ВaO2 + H2SO4 = BaSO4↓ + Н2O2 (на холоду) 2Н2O2 →MnO2→ 2Н2O + O2 2KMnO4 + 3H2SO4 + 5Н2O2 = 5O2 + 2MnSO4 + K2SO4 + 8H2O 2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2Н2O Н2O2 + O3 = 2O2 + Н2O 7.2. Сера и ее соединенияХарактерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице. 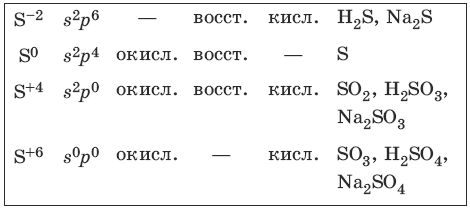
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S8. В расплаве серы существуют молекулы S8, S6, в парах серы – молекулы S6, S4, S2. Получение и свойства серы FeS2 →t→ FeS + S SO2 + 2H2S = 3S + 2H2O S + O2 →t→ SO2 Fe + S →t→ FeS Hg + S = HgS S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O Получение и свойства соединений серы (-2) FeS + 2HCl = FeCl2 + H2S H2S ↔ H+ + HS¯ ↔ 2H+ + S2- 2H2S + O2 (недостаток) = 2S↓ + 2H2O 2H2S + 3O2 (избыток) →t→ 2SO2 + 2H2O 2H2S + SO2 = 3S↓ + 2H2O H2S + I2 = S↓+ 2HI 5H2S + 3H2SO4 + 2KMnO4 = 5S↓ + 2MnSO4 + K2SO4 + 8H2O 3H2S + 4H2SO4 + K2Cr2O7 = 3S↓ + Cr2(SO4)3 + K2SO4 + 7H2O 2NaOH + H2S = Na2S + 2H2O Na2S + 2H2O ↔ NaHS + NaOH Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑ 3Na2S + Cr2(SO4)3 + 6H2O = 2Cr(OH)3↑ + 3H2S↑+ 3Na2SO4 Получение и свойства соединений серы (+4) S + О2 →t→ SO2 4FeS2 + 11O2 →t→ 2Fe2O3 + 8SO2 SO2 + Н2O ↔ H2SO3 ↔ Н+ + HSO3¯ ↔ 2Н+ + SO32- Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑ SO2 + NaOH = NaHSO3 SO2 + 2NaOH = Na2SO3 + H2O H2SO3 + 2H2S = 3S↓ + 3H2O 2SO2 + O2 →p, t, Pt → 2SO3 H2SO3 + Cl2 + H2O = H2SO4 + 2HCl 5SO2 + 2H2O + 2KMnO4 = 2H2SO4 + 2MnSO4 + K2SO4 Получение и свойства соединений серы (+6) 4FeS2 + 11O2 →t→ 2Fe2O3 + 8SO2 2SO2 + O2 →p, t, V2O5→ 2SO3 H2O + SO3 = H2SO4 H2SO4 + SO3 = H2SO4 • SO3 = H2S2O7 (олеум) H2S2O7 + H2O = 2H2SO4 Fe + H2SO4 (разб.) = FeSO4 + H2 Cu + H2SO4 (разб.) ≠ H2SO4(конц.) + H2O = H2SO4 • H2O + Q Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr. 2Fe + 6H2SO4 (конц.) →t→ Fe2(SO4)3 + 3SO2 + 6Н2O Cu + 2H2SO4 (конц.) →t→ CuSO4 + SO2 + 2Н2O 3Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O 4Ca + 5H2SO4 (конц.) = 4CaSO4 + H2S + 4H2O 2H2SO4 (конц.) + S →t→ 3SO2 + H2O 2H2SO4 (конц.) + С →t→ 2SO2 + CO2 + 2H2O 8. VIIA-группaАтомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns2np5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F2 и Cl2 – газы, Br2 – жидкость, I2 – твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ. HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему. Электронная формула атома водорода 1s1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s2. Поэтому часто водород располагают вместе с галогенами в VIIA-группе. 8.1. Водород и его соединенияВодород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице. 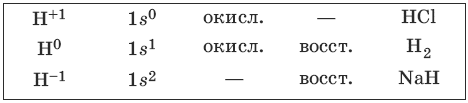
CH4 + 2Н2O →t, катализатор→ 4Н2 + CO2 Zn + 2HCl = ZnCl2 + Н2 (NaOH) + 2Н2O →электролиз раствора→ 2Н2 + O2 Н2 + 2Na →t→ 2NaH Н2 + Са →t→ СаН2 2Н2 + O2 = 2Н2O Н2 + Cl2 →hv→ 2HCl ЗН2 + N2 →t, p, катализатор→ 2NH3 NaH + Н2O = NaOH + Н2 СаН2 + 2HCl = CaCl2 + 2Н2 8.2. ВодаМолекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те. Кислород в молекуле воды находится в состоянии sp3-гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями. 2Na + 2Н2O = 2NaOH + Н2 Fe + 4Н2O →t→ Fe3O4 + 4Н2 Ag + Н2O ≠ Н2O + СаО = Са(OH)2 Н2O + Al2O3 ≠ N2O3 + Н2O = 2HNO2 2CuSO4 + 2Н2O ↔ (CuOH)2SO4 + H2SO4 H2SO4(конц.) + H2O = H2SO4 • H2O CuSO4 + 5H2O = CuSO4 • 5H2O 8.3. Фтор и его соединенияФтор является наиболее активным неметаллом, сильным окислителем. F2 + Н2 = 2HF 2F2 + 2Н2O = 4HF + O2 F2 + 2NaCl = 2NaF + Cl2 4HF + SiO2 = SiF4↑ + 2Н2O 8.4. Хлор и его соединенияХлор – тяжелый газ желто-зеленого цвета, с резким запахом. 2NaCl + 2Н2O →электролиз раствора→ Н2 + Cl2 + 2NaOH 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8Н2O MnO2 + 4HCl = Cl2 + MnCl2 + 2Н2O Cl2 + Н2 →hv→ 2HCl CH4 + Cl2 →hv→ CH3Cl + HCl С2Н4 + Cl2 = С2Н4Cl2 Cl2 + 2KBr = 2KCl + Br2 Cl2 + Н2O = HCl + HClO (реакция диспропорционирования) HClO = HCl + О (атомарный кислород – окислитель) Cl2 + 2KOH = KCl + KClO +Н2O 2Cl2 + 2Са(OH)2 = CaCl2 + Са(ClO)2 + 2Н2O Смесь CaCl2 и Са(ClO)2 – хлорная, или белильная, известь. ЗCl2 + 6KOH →100 °C→ 5KCl + KClO3 + ЗН2O KClO3 – хлорат калия, или бертолетова соль. 4KClO3 →400 °C→ KCl + ЗKClO4 2KClO3 →v→2KCl + 3O2 Сила кислот растет в ряду: HClO → HClO2 → HClO3 → HClO4. 2HCl + Fe = FeCl2 + H2↑ 2HCl + CuO = CuCl2 + H2O 3HCl + Al(OH)3 = AlCl3 + 3H2O HCl + AgNO3 = AgCl↓ + HNO3 HCl + NH3 = NH4Cl 8.5. Бром, иод и их соединенияБром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор → бром → иод. 2NaBr + Cl2 = 2NaCl + Br2 2NaI + Cl2 = 2NaCl + I2 2Al + ЗBr2 = 2AlBr3 2Al + 3I2 = 2AlI3 Br2 + Н2 ↔ 2HBr I2 + Н2 ^ 2Ш AgNO3 + NaBr = AgBr↓ + NaNO3 AgNO3 + NaI = AgI↓+ NaNO3 I2 + 2Na2S2O3 = 2NaI + Na2S4O6 10KI + 8H2SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8H2O 9. d-ЭлементыВ атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент. 9.1. Хром и его соединенияХром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s22s22p63s23p63d54s1. Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице. 
Получение и свойства хрома FeO • Cr2O3 + 4CO →t→ Fe + 2Cr + 4CO2 (Fe + 2Cr) – феррохром Сr2O3 + 2Al →t→ 2Сr + Al2O3 – метод алюминотермии Хром пассивируется на холоду концентрированными азотной и серной кислотами. Сr + 2HCl = СrCl2 + Н2 СrCl2 + 2NaOH = Cr(OH)2↓ + 2NaCl Свойства соединений хрома (+2) и хрома (+3) Гидроксид хрома(II) сразу окисляется кислородом воздуха. 4Сr(OH)2 + O2 + 2Н2O = 4Сr(OH)3 СrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl Cr(OH)3↓ + 3Na(OH) = Na3[Cr(OH)6] Cr2O3 + 2NaOH →t→ 2NaCrO2 + H2O Cr(OH)3↓ + 3HCl = CrCl3 + 3H2O 2Cr(OH)3 →t→ Cr2O3 + 3H2O 2CrCl3 + 3Cl2 + 16KOH = 2K2CrO4 + 12KCl + 8H2O 2Na3Cr(OH)6 + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8H2O Свойства соединений хрома (+6) CrO3 + Н2O = H2CrO4 2CrO3 + H2O = H2Cr2O7 Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде. К2Сr2O7 + 2KOH = 2К2СrO4 + Н2O 2K2CrO4 + H2SO4 = K2SO4 + K2Cr2O7 + Н2O (NH4)2Cr2O7 →t→ Cr2O3 + N2 + 4Н2O Дихромат калия – окислитель в кислой среде. К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O 9.2. Марганец и его соединенияМарганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице. 
Получение и свойства марганца FeO • Mn2O3 + 4CO →t→ Fe + 2Mn + 4CO2 (Fe + 2Mn) – ферромарганец Mn2O3 + 2Al →t→ 2Mn + Al2O3 – метод алюминотермии Mn + 2HCl = MnCl2 + Н2 Mn + 2H2SO4 (конц.) = MnSO4 + SO2 + 2Н2O ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO + 4Н2O Свойства соединений марганца (+2) MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 Mn(OH)2↓ + 2NaOH ≠ Mn(OH)2↓ + H2SO4 = MnSO4 + 2H2O 2Mn(OH)2↓ + O2 = MnO2↓ + 2H2O Mn(OH)2↓ + 2NaOH + Br2 = MnO2↓ + 2NaBr + 2H2O Mn(OH)2↓ →t→ MnO + H2O↑ 2Mn(NO3)2 + 16HNO3 + 5NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O 3MnCl2 + 2KClO3 + 12NaOH →сплавление→ 3Na2MnO4 + 2KCl + 6NaCl + 6H2O Свойства соединений марганца (+4) MnO2 – устойчивый амфотерный оксид, сильный окислитель. MnO2 + 4HCl = MnCl2 + Cl2 + 2Н2O 3MnO2 + KClO3 + 6KOH →сплавление→ 3K2MnO4 + KCl + 3H2O↑ Свойства соединений марганца (+6) Соединения устойчивы лишь в сильнощелочной среде. К2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4Н2O Свойства соединений марганца (+7) Сильные окислители в кислой среде. 2KMnO4 + 3H2SO4 + 5Na2SO3 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O 2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH 2KMnO4 + 2KOH + Na2SO3 = 2K2MnO4 + Na2SO4 + H2O 2KMnO4 + 8H2SO4 + 10FeSO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O 2KMnO4 + 8H2SO4 + 10KI = 2MnSO4 + 5I2 + 6K2SO4 + 8H2O 2KMnO4 + 3H2SO4 + 5NaNO2 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O 2KMnO4 →t→ K2MnO4 + MnO2 + O2↑ 9.3. Железо и его соединенияЖелезо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице. 
Соединения железа (+8) малохарактерны. Получение и свойства железа 3Fe2O3 + CO →t→ 2Fe3O4 + CO2 Fe3O4 + CO →t→ 3FeO + CO2 FeO + CO →t→ Fe + CO2 3Fe3O4 + 8Al →t→ 9Fe + 4Al2O3 Fe + I2 →t→ FeI2 2Fe + ЗCl2 →t→ 2FeCl3 4Fe + 3O2 + 2Н2O = 4FeO(OH)↓ (коррозия на воздухе) Fe + 2HCl = FeCl2 + Н2 Fe + H2SO4 (разб.) = FeSO4 + H2 Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO + 2H2O Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет. 2Fe + 6H2SO4(конц.) →t→ Fe2(SO4)3 + 3SO2 + 6Н2O Fe + 6НNO3(конц.) →t→ Fe(NO3)3 + 3NO2 + 3H2O Свойства соединений железа (+2) FeO + Н2O ≠ FeO + H2SO4 = FeSO4 + H2O FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 Гидроксид железа(II) сразу окисляется кислородом воздуха. 4Fe(OH)2↓ + 2Н2O + O2 = 4Fe(OH)3↓ Fe(OH)2↓ + H2SO4 = FeSO4 + 2Н2O Fe(OH)2↓ + 2NaOH * FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4 FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + K2SO4 Свойства соединений железа (+3) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Fe(OH)3↓ + 3HCl = FeCl3 + 3H2O Fe(OH)3↓ + NaOH ≠ не идет в разбавленном растворе Fe(OH)3↓ + NaOH →сплавление→ NaFeO2 + 2H2O FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl FeCl3 + 3KCNS = Fe(SCN)3 + 3KCl Свойства соединений железа (+6) Феррат калия – окислитель. Fe2O3 + 3KNO3 + 4KOH →сплавление→ 2K2FeO4 + 3KNO2 + 2H2O 4K2FeO4 + 10H2SO4(разб.) = 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O 9.4. Медь и ее соединенияМедь – мягкий красный металл, хорошо проводит теплоту и электрический ток. Получение и свойства меди 2CuS + 3O2 →t→ 2CuO + 2SO2 CuO + CO →t→ Cu + CO2 Cu + 2HCl + Н2O2 = CuCl2 + 2Н2O Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2Н2O Cu + 4НЖ)3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O 4Cu + O2(недостаток) →200 °C→ 2Cu2O 2Cu + O2(избыток) →500 °C→ 2CuO 2Cu + H2O + CO2 + O2 = (CuOH)2CO3↓ (малахит) Свойства соединений меди(I) 2Cu2O + O2 →500 °C→ 4CuO Cu2O + CO →t→ 2Cu + CO2 Cu2O + 4(NH3 • Н2O) (конц.) = 2[Cu(NH3)2]OH + 3H2O Свойства соединений меди(II) CuO + 2HCl = CuCl2 + Н2O CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu(OH)2↓ →t→ CuO↓ + Н2O Cu(OH)2↓ + H2SO4 = CuSO4 + 2H2O Cu(OH)2↓ + NaOH ≠ не идет в растворе Cu(OH)2↓ + 2NaOH (конц.) →t→ Na2[Cu(OH)4] CuSO4 + 4(NH3 • H2O) = [Cu(NH3)4]SO4 + 4Н2O [Cu(NH3)4]SO4 + Na2S = CuS↓ + Na2SO4 + 4NH3 2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4 2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 2Cu(NO3)2 →t→ 2CuO + 4NO2 + O2 9.5. Серебро и его соединения3Ag + 4HNO3 (разб.) = 3AgNO3 + NO↑ + 2H2O 2AgNO3 + 2NaOH = Ag2O↓ + H2O + 2NaNO3 AgNO3 + HCl = AgCl↓ + HNO3 AgCl↓ + 2(NH3 • H2O) = [Ag(NH3)2]Cl + 2H2O [Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3 Ag2O + 4(NH3 • Н2O) (конц.) = 2[Ag(NH3)2]OH + 3H2O 2[Ag(NH3)2]OH + CH3CHO + 2H2O = 2Ag↓ + CH3COONH4 + 3(NH3 • H2O) 9.6. Цинк и его соединенияПолучение и свойства цинка 2ZnS + 3O2 →t→ 2SO2 + 2ZnO ZnO + CO →t→ Zn + CO2 Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4 (разб.) = ZnSO4 + H2↑ 4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S↑ + 4H2O Zn + 4НHNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O 4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑ Свойства соединений цинка ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4 Zn(OH)2↓ + H2SO4 = ZnSO4 + 2H2O Zn(OH)2↓ + 2NaOH = Na2[Zn(OH)4] Na2[Zn(OH)4] + 2HCl = Zn(OH)2↓ + 2NaCl + 2H2O Na2[Zn(OH)4] + 4HCl = ZnCl2 + 2NaCl + 4H2O Zn(OH)2↓ + 6NH4OH = [Zn(NH3)6](OH)2 + 6H2O 2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4
Внимание !У вас нет прав для чтения и добавления комментариев. Пожалуйста авторизуйтесь или зарегистрируйтесь.Добавление комментария Есть что сказать? Пишите, нам всегда интересно знать Ваше мнение! Все вопросы по поводу данной новости оставляйте здесь, администрация и другие пользователи портала постараются Вам помочь. Пожалуйста, пишите комментарии без орфографических и пунктуационных ошибок. |
ЧасыТоп пользователей
ОнлайнОнлайн всего: 1 Гостей: 1 Пользователей: 0
|
|||||||||||||||||||






 Всего: 89
Всего: 89  Новых за месяц: 0
Новых за месяц: 0